2022-2023學年浙江省寧波市效實中學高二(上)期中化學試卷
發布:2024/10/5 0:0:1
一、選擇題(共25小題,每小題2分,共50分。每小題只有一個選項符合題意。)
-
1.下列措施不能使0.1mol/L的醋酸導電性增強的是( )
A.加水 B.加無水醋酸 C.加NaOH固體 D.通NH3 組卷:5引用:3難度:0.8 -
2.下列各項中電解質的電離方程式正確的是( )
A.氨水:NH3?H2O═ +OH-NH+4B.H2S的水溶液:H2S?2H++S2- C.HF的水溶液:HF═H++F- D.NaHCO3的水溶液:NaHCO3═Na++ HCO-3組卷:28引用:4難度:0.7 -
3.下列粒子對水的電離沒有影響的是( )
A.CH3COOH B. 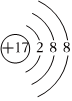
C.M-:1s22s22p6 D. 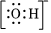 組卷:19引用:3難度:0.8
組卷:19引用:3難度:0.8 -
4.下列生活中常用的方法,其原理與鹽類的水解反應有關的是( )
A.用草木灰去除油污 B.用氫氫化鋁中和過多胃酸 C.用食鹽腌制臘肉 D.用白醋清洗水壺中的水垢 組卷:30引用:4難度:0.8 -
5.下列說法錯誤的是( )
A.下列離子在溶液中能大量共存:Al3+、Na+、S2-、 NO-3B.為保存FeCl3溶液,要在溶液中加入少量鹽酸 C.實驗室盛放Na2CO3,Na2SiO3等溶液的試劑瓶應用橡皮塞,而不能用玻璃塞 D.相同濃度的NaX、NaY、NaZ的溶液,其pH依次增大則HX、HY、HZ的酸性依次減弱 組卷:2引用:3難度:0.7 -
6.下列對氨水溶液中存在的電離平衡NH3?H2O?NH4++OH-敘述正確的是( )
A.加水后,溶液中n(OH-)增大 B.加入少量濃鹽酸,溶液中c(OH-)增大 C.加入少量濃NaOH溶液,電離平衡正向移動 D.加入少量NH4Cl固體,溶液中c(NH4)減少 組卷:66引用:6難度:0.5 -
7.基于構造原理填充順序,下列原子軌道的能量大小比較,正確的是( )
A.E(4s)<E(3d) B.E(3s)>E(3p) C.E(4s)<E(3p) D.E(2px)<E(2py) 組卷:50引用:4難度:0.6 -
8.將K2SO4溶液從常溫加熱至90℃,下列敘述正確的是( )
A.水的離子積變大、pH變小、呈酸性 B.水的離子積不變、pH不變、呈中性 C.水的離子積變小、pH變大、呈堿性 D.水的離子積變大、pH變小、呈中性 組卷:16引用:3難度:0.5 -
9.下列說法正確的是( )
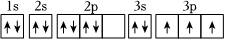
A.在①P、S;②Mg、Ca;③Al、Si三組元素中,每組中第一電離能較大的元素的原子序數和為41 B.放煙花時看到的焰色是某些金屬原子的電子吸收能量后發生電子躍遷的結果,屬于吸收光譜 C.Al原子激發態能量: 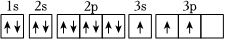 >
>
D.電子排布式1s22s22p63s23p63d3違反了泡利原理 組卷:4引用:2難度:0.7 -
10.在一定溫度下,氯化銀在水中存在如下沉淀溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq),若把AgCl分別放入①100mL0.1mol/LNaNO3溶液中;②100mL0.1mol/LNaCl溶液中;③100mL0.1mol/LAlCl3溶液中;④100mL0.1mol/LMgCl2溶液中,攪拌后在相同的溫度下Ag+濃度由大到小的順序是( )
A.①>②>④>③ B.②>①>④>③ C.④>③>②>① D.①>④>③>② 組卷:26引用:3難度:0.6
二、填空題(本大題共5小題,共50分)
-
29.工業上納米TiO2的制備過程是以N2為載體,用TiCl4和水蒸氣反應生成Ti(OH)4,再控制溫度生成納米xTiO2?yH2O,測定產物xTiO2?yH2O組成的方法如下:
步驟一:取樣品2.100g用稀硫酸充分溶解得到TiOSO4溶液,再用足量鋁將TiO2+還原為Ti3+,過濾并洗滌,將所得濾液和洗滌液混合并注入250mL容量瓶,定容得到待測液。
步驟二:取待測液于錐形瓶中,加入幾滴指示劑,用0.1mol/L的NH4Fe(SO4)2標準溶液滴定,將Ti3+氧化為TiO2+,三次滴定測得數據記錄如下:
回答下列問題:實驗編號 待測溶液的體積/mL 滴定前標準液的體積讀數/mL 滴定后標準液的體積讀數/mL 1 25.00 0.20 24.22 2 25.00 1.21 29.21 3 25.00 1.50 25.48
(1)若對步驟一所得的TiOSO4溶液加水稀釋,溶液中會產生少量偏鈦酸(H2TiO3)沉淀,寫出該反應的離子方程式。
(2)已知NH4Fe(SO4)2溶液顯酸性,滴定時,將標準溶液注入(填“酸”或“堿”)式滴定管中。
(3)上述滴定實驗中,可選擇為指示劑,判斷到達滴定終點的方法是。
(4)下列關于滴定分析的操作,錯誤的是。
A.滴定時要適當控制滴定速率
B.用量筒量取25.00mL待測液轉移至錐形瓶
C.滴定時應一直觀察滴定管中溶液體積的變化
D.平行滴定時,須重新裝液并調節液面至“0”刻度或“0”刻度以下
E.在接近終點時,滴加藥品應慢慢控制滴定管,使滴定管尖嘴懸掛一滴液體,用錐形瓶內壁將其靠下,并用蒸餾水將其沖入錐形瓶內。
(5)通過分析、計算,該樣品的組成為(寫出計算過程);若滴定前滴定管尖端有氣泡,滴定過程中氣泡消失,則測得比實際值xy(填“偏大”、“偏小”或“無影響”)。組卷:5引用:3難度:0.5 -
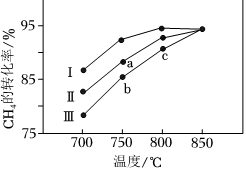 30.甲烷水蒸氣催化重整是制備高純氫的方法之一。反應如下:
30.甲烷水蒸氣催化重整是制備高純氫的方法之一。反應如下:
反應ⅰ.CH4(g)+H2O(g)?CO(g)+3H2(g)ΔH1=+206kJ?mol-1;
反應ⅱ.CH4(g)+2H2O(g)?CO2(g)+4H2(g)ΔH2=+165 kJ?mol-1;
回答下列問題:
(1)反應ⅲ.CO2(g)+H2(g)?CO(g)+H2O(g)的ΔH3=kJ?mol-1;若在一定溫度下的容積固定的密閉容器中進行該反應,則可以提高CO2平衡轉化率的措施有(寫出一條即可)
(2)對于反應ⅰ,向體積為2L的恒容密閉容器中,按n(H2O):n(CH4)=1:1投料。
①若在恒溫條件下,反應達到平衡時CH4的轉化率為50%,則平衡時容器內的壓強與起始壓強之比為(最簡單整數比)。
②其他條件相同時,在不同催化劑(Ⅰ、Ⅱ、Ⅲ)作用下,反應相同時間,CH4的轉化率隨反應溫度的變化如圖所示。a點(填“是”或“不是”)化學平衡狀態,CH4的轉化率:c點>b點,原因是。
(3)甲烷水蒸氣催化重整制備高純氫只發生反應ⅰ、反應ⅱ。在恒溫、恒壓條件下,1molCH4(g)和1molH2O(g)反應達平衡時,CH4(g)的轉化率為a,CO2(g)的物質的量為bmol,則反應ⅰ的平衡常數Kx=[寫出含有a、b的計算式;對于反應mA(g)+nB(g)?pC(g)+qD(g),Kx=,x為物質的量分數]。若改變下列條件反應ⅰ的平衡常數Kx會變大的是xp(C)?xq(D)xm(A)?xn(B)(填字母):
A、升高溫度
B、降低溫度
C、增大壓強(通過縮小反應體積)
D、減小壓強(通過擴大反應體積)
E、使用催化劑組卷:24引用:1難度:0.5


