2023-2024學年蘇教版(2019)高二(上)模塊化學試卷(選擇性必修1 化學反應原理)
發布:2024/8/16 0:0:1
一、選擇題
-
1.下列關于能量變化的說法正確的是( )
A.“冰,水為之,而寒于水”說明相同質量的水和冰相比較,冰的能量高 B.化學反應在物質變化的同時,伴隨著能量變化,其表現形式只有吸熱和放熱兩種 C.已知C(石墨,s)═C(金剛石,s)ΔH>0,則金剛石比石墨穩定 D.化學反應遵循質量守恒的同時,也遵循能量守恒 組卷:112引用:37難度:0.9 -
 2.保護埋在地下的鋼管常用如圖所示方法加以保護,使其免受腐蝕.關于此方法,下列說法正確的是( )
2.保護埋在地下的鋼管常用如圖所示方法加以保護,使其免受腐蝕.關于此方法,下列說法正確的是( )A.金屬棒X的材料可能為銅 B.金屬棒X的材料可能為鈉 C.鋼管附近土壤的pH可能會上升 D.這種方法稱為外加電流的陰極保護法 組卷:51引用:7難度:0.9 -
3.下列關于判斷過程的方向的說法正確的是( )
A.所有自發進行的化學反應都是放熱反應 B.判斷化學反應能否自發進行,必須綜合考慮反應的焓變和熵變 C.自發反應一定是熵增大,非自發反應一定是熵減小的反應 D.同一物質的固、液、氣三種狀態中固體的熵值最大 組卷:14引用:4難度:0.9 -
4.下列說法正確的是( )
A.在船身上裝鋅塊是利用犧牲陽極的陰極保護法來避免船體遭受腐蝕 B.反應Hg(1)+H2SO4(aq)═HgSO4(aq)+H2(g)在常溫下不能自發進行,則ΔH<0 C.將純水加熱至較高溫度,Kw變大、pH變小、呈酸性 D.在反應KIO3+6HI═KI+3I2+3H2O中,每生成3mol I2轉移的電子數為6×6.02×1023 組卷:29引用:3難度:0.7
二、解答題
-
13.水體中的六價鉻[Cr(Ⅵ)]對生態環境和人體健康威脅很大。工業廢水中[Cr(Ⅵ)]常用還原沉淀法、微生物法等進行處理。
(1)“還原沉淀法”常用Na2SO3、FeSO4等處理Cr(Ⅵ)得到Cr(Ⅲ)。
已知溶液中含Cr(Ⅵ)的微粒(H2CrO4、Cr2和O2-7)的物質的量分數隨pH的關系如圖1所示。CrO2-4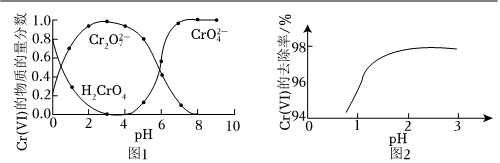
①某含Cr(Ⅵ)廢水的pH約為8,寫出用Na2SO3處理該廢水的主要離子方程式:。[已知pH=3時,Cr(Ⅲ)以Cr3+形式存在,pH=7.5時,Cr(Ⅲ)開始沉淀]。
②其他條件相同,用Na2SO3處理不同pH含Cr(Ⅵ) 的廢水,反應相同時間,Cr(Ⅵ)的去除率與pH的關系如圖2所示。已知酸性條件下Cr(Ⅵ)對Na2SO3具有很強的氧化能力,pH<2時,Cr(Ⅵ)的去除率隨pH降低而降低的原因是。
③研究發現,用FeSO4處理pH=3的含Cr(Ⅵ)廢水,Cr(Ⅵ)的去除率大于其被FeSO4還原的理論值。Cr(Ⅵ)的去除率大于理論值的原因是。
(2)“微生物法”處理含Cr(Ⅵ)廢水具有效率高、選擇性強、吸附容量大等優點。一種微生物法是用硫酸鹽還原菌(SRB)處理含Cr(Ⅵ)廢水。
①硫酸鹽還原菌能將水中的轉化為S2-,S2-與SO2-4可反應生成Cr2S3和S兩種沉淀。寫出S2-與CrO2-4反應的離子方程式:CrO2-4。
②用硫酸鹽還原菌(SRB)處理含鉻廢水時,溫度常控制在30℃左右,溫度過高,Cr(Ⅵ)的去除率低的原因是。
③硫酸鹽還原菌(SRB)常存在于水體中,會腐蝕許多金屬及合金。一種Fe合金在硫酸鹽還原菌存在條件下腐蝕的機理如圖3所示。已知溶液中的S2-會完全轉化為FeS,則Fe腐蝕后生成Fe(OH)2和FeS的物質的量之比為。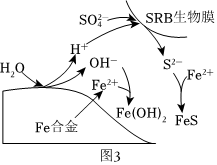 組卷:68引用:3難度:0.6
組卷:68引用:3難度:0.6 -
14.鐵、鋁及其化合物在生產和生活中有著廣泛的應用。
(1)某研究性學習小組設計了如圖所示裝置探究鋼鐵的腐蝕與防護。
為防止金屬Fe被腐蝕,可以采用上述(填裝置序號)裝置原理進行防護;裝置③中總反應的離子方程式為。
(2)用甲烷或其他有機物、氧氣為原料可設計成原電池,以CH3OH、O2為原料,20%氫氧化鈉溶液為電解質設計成燃料電池,則負極的電極反應式為。
(3)圖1是在金屬鋅板上貼上一張用某溶液浸濕的濾紙,圖2是NaBH4/H2O2燃料電池。
圖1若用硫酸鈉和酚酞的混合溶液浸濕濾紙,用導線將a、b直接相連,則濾紙出現色,c位置的電極反應式為。
圖1若用KI-淀粉溶液浸濕濾紙,用導線將a、b與A、B電極相連,鉛筆芯c點處出現藍色,則b接的是(填“A”或“B”)電極。
圖2電池中每消耗3molH2O2轉移電子數目 是個,正極區發生的電極反應為,負極區的電極反應為。組卷:22引用:3難度:0.5


