2022-2023學年重慶市長壽中學高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題包括14小題,每小題3分,共42分,每小題只有1個選項符合題意)
-
1.下列與化學反應能量變化相關的敘述正確的是( )
A.焓變是指1mol物質參加反應時的能量變化 B.在一個化學反應中,當反應物總焓小于生成物的總焓時,ΔH為負值 C.應用蓋斯定律,可計算某些難以直接測量的反應焓變 D.同溫同壓下,H2(g)+Cl2(g)═2HCl(g)在光照和點燃條件下的ΔH不同 組卷:7引用:1難度:0.6 -
2.如圖是H2與Cl2發生反應生成HCl的途徑和三個狀態的能量,有關說法錯誤的是( )
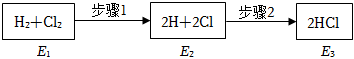
A.步驟2是放熱過程 B.步驟1的轉化,必須加熱 C.三個狀態的能量E2最大 D.該反應的ΔH<0 組卷:3引用:1難度:0.6 -
3.下列措施不是為了改變化學反應速率的是( )
A.加工饅頭時添加膨松劑 B.將食物存放在冰箱中 C.糕點包裝袋內放置除氧劑 D.冶鐵時將鐵礦石粉碎 組卷:46引用:11難度:0.5 -
4.10mL濃度為1mol?L-1的硫酸與過量的鋅粉反應,下列措施能加快反應速率但又不影響氫氣生成量的是( )
①加入少量CuSO4溶液②改用質量分數98%的硫酸③加入少量K2SO4溶液④升高溫度⑤再加入20mL1mol?L-1的硫酸( )A.①④ B.①② C.③④ D.④⑤ 組卷:11引用:1難度:0.7 -
5.“藍天保衛戰”需要持續進行大氣治理,有效處理SO2、NO2等大氣污染物。化學研究為生產、生活處理廢氣,防止大氣污染做出重要貢獻。已知反應:SO2(g)+NO2(g)?SO3(g)+NO(g) ΔH=-41.8kJ?mol-1,運用該反應處理廢氣時有關說法正確的是( )
A.增大壓強有利于反應自發進行 B.該反應不能完全消除廢氣 C.降低反應溫度可提高去除效率 D.升高反應溫度可提高廢氣轉化率 組卷:6引用:1難度:0.5 -
6.有以下三個反應
①H2(g)+O2(g)═H2O(g) ΔH112
②H2(g)+O2(g)═H2O(l) ΔH212
③2H2(g)+O2(g)═2H2O(l) ΔH3
下列說法錯誤的是( )A.ΔH1、ΔH2、ΔH3均小于0 B.2ΔH2=ΔH3 C.ΔH1>ΔH2 D.2ΔH1<ΔH3 組卷:6引用:1難度:0.6
二、非選擇題(本大題共4小題,共58分)
-
17.氨在國民經濟生產中占有重要地位。如圖是合成氨的簡要流程:
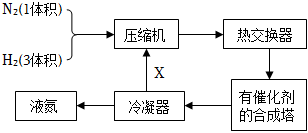
N2(g)+3H2(g)?2NH3(g) ΔH<0
(1)圖中X是,這樣操作的目的是。
(2)T℃時在容積為2L的密閉恒容容器中充入0.8molN2(g)和1.6molH2(g),5min后達到平衡,測得N2的濃度為0.2mol/L。
①計算此段時間的反應速率v(NH3)=,H2的轉化率=。
②已知300℃時K=0.86,則(2)中的反應溫度T300(填“>”“<”或“=”)。若向平衡后的體系中同時加入1.2molN2、1.6molH2、1.2molNH3,平衡將(填“正向移動”、“不移動”或“逆向移動”)。
(3)下列措施可提高N2平衡轉化率的是(填序號)。
a.恒容時充入H2,使體系總壓強增大
b.恒容時將NH3從體系中分離
c.恒容時充入He,使體系總壓強增大
d.加入合適的催化劑
(4)科學家一直致力于研究常溫、常壓下“人工固氮”的新方法。曾有實驗報道:在低溫、常壓、光照條件下,N2在催化劑(摻有少量Fe2O3的TiO2)表面與水發生反應:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)ΔH=+765.2kJ?mol-1。進一步研究NH3生成量與溫度的關系,部分實驗數據見下表(光照、壓強1.0×105Pa、反應時間3h):
當溫度高于323K時,NH3的生成量反而降低的可能原因是T/K 303 313 323 353 NH3生成量/(×10-6mol) 4.8 5.9 6.0 2.0 。組卷:6引用:1難度:0.5 -
18.將CO2轉化為CO、CH3OH等燃料,可以有效的緩解能源危機,同時可以減少溫室氣體,實現“雙碳目標”。回答下列問題:
(1)以800℃時,H2還原CO2反應的熱化學方程式及其平衡常數如下:
Ⅰ:CO2(g)+H2(g)?CO(g)+H2O(g)ΔH1=+41kJ?mol-1 K1=104
Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) ΔH2=-49.5kJ?mol-1 K2=10-3
①反應CO(g)+2H2(g)?CH3OH(g) ΔH3=kJ?mol-1 K3=。
②反應Ⅰ的反應趨勢遠大于反應Ⅱ,其原因是。
③對于反應Ⅱ溫度升高,平衡移動(填“向左”“向右”或“不”);增大壓強,平衡常數(填“變大”“變小”或“不變”)。
(2)在1.0×105Pa,將4molH2與1molCO2進行反應,體系中氣體平衡組成比例(物質的量分數)隨溫度變化的理論計算結果如圖所示。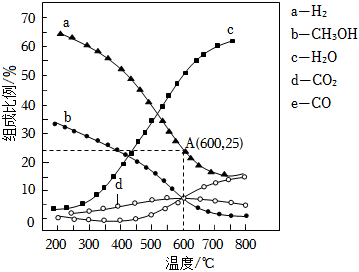
反應CO(g)+2H2(g)?CH3OH(g) 的平衡常數Kp(600℃)=Pa-2,600℃時平衡體系中H2O的物質的量分數是。[對于氣相反應,用某組分(B)的平衡分壓(pB)代替其物質的量濃度(cB)也可以表示平衡常數(記作Kp),已知:B的平衡分壓=總壓×平衡時B的物質的量分數,結果保留一位小數]組卷:7引用:1難度:0.5


