2022-2023學(xué)年山東省濟(jì)南市章丘四中高二(上)期中化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題:本題共10小題,每小題2分,共20分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.化學(xué)與生產(chǎn)、生活密切相關(guān),下列說法正確的是( )
A.乙醇燃燒是將熱能轉(zhuǎn)化為化學(xué)能 B.煤的氣化是煤在高溫條件下由固態(tài)轉(zhuǎn)化為氣態(tài)的物理變化過程 C.金屬在潮濕的空氣中生銹,主要發(fā)生吸氧腐蝕 D.葡萄酒中添加適量SO2,可以起到抗氧化和漂白的作用 組卷:13引用:1難度:0.5 -
2.下列電離方程式書寫正確的是( )
A.HF的電離方程式:HF+H2O?F-+H3O+ B.FeCl3在水中的電離方程式:FeCl3?Fe3++3Cl- C.碳酸的電離方程式:H2CO3?2H++CO32- D.NaHSO4在熔融狀態(tài)下的電離方程式:NaHSO4═Na++H++SO42- 組卷:27引用:3難度:0.9 -
3.下列物質(zhì)的分類正確的是( )
選項 混合物 電解質(zhì) 強(qiáng)電解質(zhì) 弱電解質(zhì) A 明礬 H2O H2SO4 CH3COOH B 堿石灰 燒堿 KOH BaSO4 C 鹽酸 液氨 Na2CO3 HClO D 空氣 K2O NH4Cl H2CO3 A.A B.B C.C D.D 組卷:43引用:1難度:0.8 -
4.下列說法正確的是( )
A.放電時,鉛酸蓄電池的負(fù)極質(zhì)量減輕 B.工業(yè)上常采用電解NaCl的水溶液的方法來制取金屬單質(zhì)鈉 C.粗銅精煉時,粗銅應(yīng)與電源的負(fù)極相連 D.馬口鐵(表面鍍錫薄鋼板)的表面破損時,馬口鐵會較純鐵腐蝕更嚴(yán)重 組卷:17引用:1難度:0.5 -
5.室溫下,兩種酸在水中的電離示意圖(
 代表H3O+)如圖,下列有關(guān)說法錯誤的是( )
代表H3O+)如圖,下列有關(guān)說法錯誤的是( )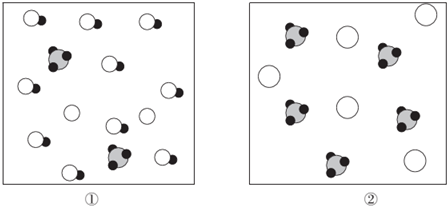
A.圖②代表強(qiáng)酸在水中的電離情況 B.兩種酸溶液中均存在電離平衡:2H2O?H3O++OH- C.若圖①溶液的pH=a,則將溶液稀釋10倍后,pH=a+1 D.兩種酸溶液中由水電離出的c(H+)<10-7mol?L-1 組卷:18引用:4難度:0.6 -
6.設(shè)NA為阿伏加德羅常數(shù)的值,下列說法正確的是( )
A.1LpH=1的H2SO4溶液中,所含的H+離子總數(shù)為0.2NA B.1L0.1mol?L-1FeCl3溶液中,所含的陽離子總數(shù)大于0.1NA C.一定條件下,在某一恒容密閉容器中,0.1molN2和0.3molH2充分反應(yīng)后,生成的NH3分子總數(shù)為0.2NA D.0.5L0.1mol?L-1HNO2溶液中,所含的HNO2分子總數(shù)為0.05NA 組卷:65引用:6難度:0.5
三、非選擇題:本題共5小題,共60分。
-
19.已知室溫下有關(guān)弱酸的電離平衡常數(shù)如表所示:
回答下列問題:弱酸 HClO HF CH3COOH HNO2 電離平衡常數(shù) 4.0×10-8 6.4×10-4 1.8×10-5 5.6×10-4
(1)HNO2的電離方程式為。
(2)上述HClO、CH3COOH、HF三種酸的酸性由強(qiáng)到弱的順序為(填分子式)。
(3)向濃度均為0.1mol?L-1的HClO溶液和CH3COOH溶液中加入H2O:
①若加H2O稀釋至相同的pH,則溶液中加入H2O的體積:V(HClO)(填“>”、“<”或“=”)V(CH3COOH)。
②若加H2O稀釋相同的倍數(shù),則此時溶液的pH:pH(HClO)(填“>”、“<”或“=”)pH(CH3COOH)。
(4)室溫下,向未知濃度的HF溶液中加入NaOH溶液:
①溶液中n(F-)(填“增大”、“減小”、“不變”或“無法判斷”)。
②滴加NaOH溶液至溶液中的c(F-)=c(Na+),此時溶液的pH(填“>”、“<”或“=”)7,判斷的理由為。
(5)若向0.2mol?L-1的HClO溶液中滴加等體積一定濃度的稀硫酸,此時測得溶液中的c(H+)=0.04mol?L-1,則溶液中c(ClO-)=mol?L-1。組卷:32引用:5難度:0.5 -
20.CO2是導(dǎo)致溫室效應(yīng)的主要?dú)怏w,為減少CO2對環(huán)境造成的影響,可采用以下方法將其資源化利用。回答下列問題:
(1)工業(yè)上用CO2與H2反應(yīng)合成甲醇(a和b均大于零):
①2H2(g)+O2(g)?2H2O(g)K1 ΔH1=-akJ?mol-1;
②2CH3OH(g)+3O2(g)?2CO2(g)+4H2O(g)K2 ΔH2=-bkJ?mol-1;
③CO2(g)+3H2?CH3OH(g)+H2O(g)K3 ΔH3。
則K3=(用含K1、K2的代數(shù)式表示),ΔH3=kJ?mol-1(用含a、b的代數(shù)式表示)。
(2)CO2催化加氫合成乙烯:往某恒容密閉容器中,充入1.0molCO2和4.0molH2,發(fā)生反應(yīng):2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)ΔH,當(dāng)反應(yīng)達(dá)到平衡時,測得H2的物質(zhì)的量分?jǐn)?shù)隨溫度的變化曲線如圖所示:
①對于2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)ΔH,下列說法正確的是(填標(biāo)號)。
A.該反應(yīng)中反應(yīng)物的總鍵能小于生成物的總鍵能
B.升高溫度,該反應(yīng)的ΔH的值增大
C.加入合適的催化劑,有利于提高CO2的轉(zhuǎn)化率
D.當(dāng)混合氣體的相對分子質(zhì)量不再隨時間而改變,則該反應(yīng)達(dá)到平衡
②若反應(yīng)達(dá)到平衡時,a點(diǎn)時容器內(nèi)氣體的總壓強(qiáng)為0.5MPa,則該反應(yīng)的平衡常數(shù)Kp=(MPa)-3(列出計算式即可,用分壓表示,分壓=總壓×物質(zhì)的量分?jǐn)?shù))。
(3)草酸鋅可應(yīng)用于有機(jī)合成、電子工業(yè)等。工業(yè)上制取ZnC2O4的原理如圖所示(電解液不參加反應(yīng)):
①該電池屬于(填“電解池”或“原電池”)。
②Pt電極上的電極反應(yīng)式為。
③每轉(zhuǎn)移0.2mol電子,此時消耗CO2的體積為L(標(biāo)準(zhǔn)狀況下)。
(4)CO2用途廣泛,寫出基于其物理性質(zhì)的一種用途:。組卷:11引用:1難度:0.6


