2017-2018學年福建省福州三中高二(上)期末化學試卷
發布:2024/11/7 9:30:3
一、選擇題(共24小題,每小題3分,滿分72分)
-
1.下列微粒的表示方法中正確的是( )
A. 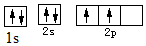 碳原子價電子軌道表示式
碳原子價電子軌道表示式B.乙酸乙酯的結構簡式 CH3COOCH3CH2 C.氯化氫的電子式:H:Cl D.中子數為16的磷原子 P3115組卷:2引用:1難度:0.7 -
2.若aAm+與bBn-的核外電子排布相同,則下列關系不正確的是
A.a-m=b+n B.離子半徑Am+>Bn- C.A的原子序數比B大(m+n) D.原子半徑A>B 組卷:3引用:1難度:0.5 -
3.下列基態原子或離子的電子排布式錯誤的是( )
A.Cr:[Ar]3d44s2 B.F-:1s22s22p6 C.K+:1s22s22p63s23p6 D.S:1s22s22p63s23p4 組卷:14引用:1難度:0.8 -
4.下列物質中,屬于含極性鍵的非極性分子的是( )
A.NaCl B.CCl4 C.NH3 D.H2O2 組卷:4引用:1難度:0.7 -
5.對Na、Mg、Al的有關性質的敘述正確的是( )
A.堿性:NaOH<Mg(OH)2<Al(OH)3 B.第一電離能:Na<Mg<Al C.電負性:Na>Mg>Al D.還原性:Na>Mg>Al 組卷:93引用:71難度:0.7 -
6.Li-Mg、Be-Al、B-Si在元素周期表中有特殊“對角線”關系,它們的性質相似,下列有關敘述錯誤的是
( )A.Li2SO4難溶于水 B.Be(OH)2為兩性氫氧化物 C.硼晶體為原子晶體 D.BeCl2是共價化合物 組卷:22引用:2難度:0.7 -
7.根據元素周期表和元素周期律,判斷下列敘述正確的是( )
A.第ⅦA族元素從上到下,其氫化物的穩定性逐漸增強 B.氫元素與其他元素可形成共價化合物或離子化合物 C. 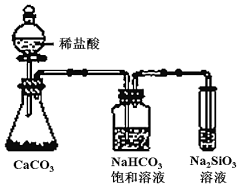
如圖所示實驗可證明元素的非金屬性強弱Cl>C>SiD.同主族元素從上到下,單質的熔點逐漸升高 組卷:37引用:2難度:0.6 -
8.短周期主族元素X、Y、Z、W的原子序數依次增大,X原子核外最外層電子數是其電子層數的2倍,X、Y的核電荷數之比為3:4,W-的最外層為8電子結構,金屬單質Z在空氣中燃燒生成的化合物可與水發生氧化還原反應,下列說法正確的是( )
A.X與Y能形成多種化合物,一般條件下都能與Z的最高價氧化物的水化物發生反應 B.原子半徑大小:X<Y,Z>W C.化合物Z2Y和ZWY3都只存在離子鍵 D.Y、W的某些單質或兩元素之間形成的某些化合物可作水的消毒劑 組卷:1141引用:50難度:0.9 -
9.下列關于乙醛的說法錯誤的是( )
A.一個乙醛分子有6個σ鍵,1個π鍵 B.乙醛分子中存在非極性鍵 C.乙醛在催化劑銅存在下可以氧化生成乙醇 D.乙醛晶體屬于分子晶體 組卷:82引用:1難度:0.8
二、解答題(共5小題,滿分0分)
-
28.太陽能的開發利用在新能源研究中占據重要地位.單晶硅太陽能電池片在加工時,一般摻雜微量的锎.硼.鎵.硒等。回答下列問題:
(1)硒的基態原子的電子排布式為。已知銅和某元素M的電負性分別是1.9和3.0,則銅與M形成的化合物屬于(填“離子”,“共價”)化合物。已知高溫下Cu2O比CuO更穩定,試從銅原子核外電子結構變化角度解釋。
(2)銅與類鹵素(SCN)2反應生成Cu(SCN)2,類鹵素(SCN)2對應的酸有兩種,理論上硫氰酸(H-S-C≡N )的沸點低于異硫氰酸(H-N=C=S)的沸點.其原因是。
(3)硼元素具有缺電子性,其化合物可與具有孤電子對的分子或離子形成配合物,如BF3能與NH3反應生成BF3?NH3。在BF3?NH3中B原子的雜化方式為,B與N之間形成配位鍵,氮原子提供。寫出一種與NH3互為等電子體的離子的化學式。
(4)含硼化合物是一種常見的還原劑,結構如圖1所示。請在圖中畫出配位鍵。
(5)多硼酸根離子可以通過三角形共用原子連接成鏈狀,片狀或者三維網狀多硼酸根離子。如圖2是無限長單鏈結構的多硼酸根離子,其中與原子數之比為,化學式為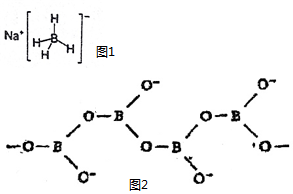 組卷:6引用:1難度:0.6
組卷:6引用:1難度:0.6 -
29.利用某工業廢鐵粉(主要成分為Fe2O3、Fe等)與硫酸反應可制備硫酸亞鐵。
(1)Fe元素在周期表中的位置是。寫出該廢鐵粉與硫酸主要反應的離子方程式。
(2)FeSO4隔絕空氣受熱分解生成SO2SO3Fe2O3。SO2分子的空間構型為,其中S原子的雜化軌道類型為。與SO2互為等電子體的離子與分子分別為,。(填化學式)
(3)苯酚溶液中滴入Fe3+離子,溶液顯色。1mol苯酚中含有σ鍵的數目為。
(4)Fe3O4有反尖晶石結構。某化合物MgxAlyOz與反尖晶石結構相仿,其結構如圖1所示,它是由下列A、B方塊組成。該化合物的化學式為。
(5)常溫條件下,鐵的晶體采用如圖2所示的堆積方式。則這種堆積模型的配位數為,如果鐵的原子半徑為0.12nm,阿伏加德羅常數的值為NA,則此種鐵單質的密度表達式為g/cm3。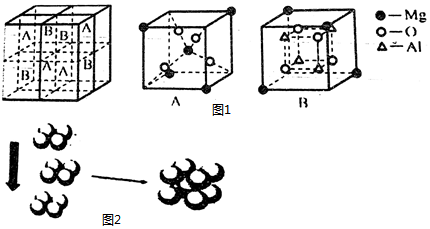 組卷:1引用:1難度:0.6
組卷:1引用:1難度:0.6


