2016-2017學(xué)年山東省棗莊市滕州十一中高三(上)第四周同步檢測(cè)化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題
-
1.化學(xué)與能源開發(fā)、環(huán)境保護(hù)、資源利用等密切相關(guān).下列說法正確的是( )
A.“無磷洗滌劑”的推廣使用,不能有效減少水體富營(yíng)養(yǎng)化的發(fā)生 B.無論是風(fēng)力發(fā)電還是火力發(fā)電,都是將化學(xué)能轉(zhuǎn)化為電能 C.PM2.5含有的鉛、鎘、鉻、釩、砷等對(duì)人體有害的元素均是金屬元素 D.硫的氧化物和氮的氧化物是形成酸雨的主要物質(zhì) 組卷:10引用:4難度:0.9 -
2.最新報(bào)道:科學(xué)家首次用X射線激光技術(shù)觀察到CO與O在催化劑表面形成化學(xué)鍵的過程。反應(yīng)過程的示意圖如下:
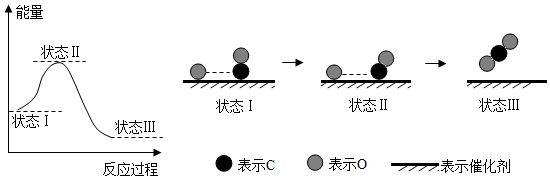
下列說法正確的是( )A.CO和O生成CO2是吸熱反應(yīng) B.在該過程中,CO斷鍵形成C和O C.CO和O生成了具有極性共價(jià)鍵的CO2 D.狀態(tài)Ⅰ→狀態(tài)Ⅲ表示CO與O2反應(yīng)的過程 組卷:946引用:78難度:0.9 -
3.在一定條件下活性鐵粉與氨氣反應(yīng)合成半導(dǎo)體材料:8Fe(s)+2NH3(g)
2Fe4N(s)+3H2(g)640℃
下列有關(guān)NH3、H2的推斷正確的是( )A.上述參加反應(yīng)的NH3和生成H2的體積之比為3:2 B.同溫同壓下,NH3、H2的密度之比為2:17 C.相同質(zhì)量的NH3、H2分子數(shù)之比為17:2 D.同溫同體積下,相同質(zhì)量NH3、H2的壓強(qiáng)之比為2:17 組卷:63引用:4難度:0.9 -
4.設(shè)NA為阿伏加德羅常數(shù)值.下列有關(guān)敘述錯(cuò)誤的是( )
A.14 g乙烯和丙烯混合氣體中的氫原子數(shù)為NA B.1 mol N2與4 mol H2反應(yīng)生成的NH3分子數(shù)小于2NA C.1 mol Fe溶于過量硝酸,電子轉(zhuǎn)移數(shù)為3NA D.標(biāo)準(zhǔn)狀況下,2.24 L CH4含有的共價(jià)鍵數(shù)為0.4NA 組卷:308引用:80難度:0.9 -
5.常溫下,下列各組離子一定能在指定溶液中大量共存的是( )
A.c(I-)=0.1mol?L-1的溶液中:Na+、Mg2+、ClO-、 SO2-4B.使甲基橙變紅色的溶液中:K+、 、NH+4、Cl-HCO-3C.與Al反應(yīng)能放出大量H2的溶液中:Fe2+、Na+、 、Cl-NO-3D.由水電離產(chǎn)生的c(OH-)=1×10-10 mol?L-1的溶液中:Ba2+、K+、 、Br-NO-3組卷:29引用:4難度:0.7 -
6.能正確表示下列反應(yīng)的離子方程式為( )
A.CaCl2溶液中通入CO2:Ca2++CO2+H2O═CaCO3↓+2H+ B.酸性KMnO4溶液中通入SO2:5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+ C.FeBr2溶液中通入足量Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- D.AgCl懸濁液中通HI:Ag++HI═AgI↓+H+ 組卷:28引用:4難度:0.7 -
7.大氣中的SO2是造成酸雨的主要污染物。最新研究表明,離子晶體[N(CH3)4]2SO4(s)能與SO2進(jìn)行如下可逆反應(yīng),使其可能成為綠色的SO2吸收劑:[N(CH3)4]2SO4(s)+SO2(g)?[N(CH3)4]2S2O6(s)下列說法正確的是( )
A.[N(CH3)4]+中只含共價(jià)鍵 B.該反應(yīng)中,SO2作氧化劑 C.SO2漂白品紅是利用其強(qiáng)氧化性 D.每吸收標(biāo)準(zhǔn)狀況下的SO211.2L,生成15.4g[N(CH3)4]2 S2O6 組卷:5引用:1難度:0.9 -
8.已知反應(yīng):10AgF+5Cl2+5H2O=9AgCl+AgClO3+10HF+O2 下列關(guān)于該反應(yīng)的敘述不正確的是( )
A.該反應(yīng)中,氧化劑與還原劑物質(zhì)的量之比為9:5 B.當(dāng)反應(yīng)中有1mol電子轉(zhuǎn)移時(shí),被還原氯氣物質(zhì)的量為 mol118C.每產(chǎn)生1mol O2時(shí),被氧元素還原的氯氣物質(zhì)的量為2mol D.參加反應(yīng)的水有 被氧化25組卷:83引用:18難度:0.9 -
9.據(jù)最新報(bào)道,科學(xué)家發(fā)現(xiàn)了如下反應(yīng):O2+PtF6═O2(PtF6),已知O2(PtF6)為離子化合物,其中Pt的化合價(jià)為+5,對(duì)于此反應(yīng),下列說法正確的是( )
A.O2 是氧化劑,PtF6 是還原劑 B.O2(PtF6)中氧元素的化合價(jià)為+1 C.O2(PtF6)中不存在共價(jià)鍵 D.每生成1mol O2(PtF6)則轉(zhuǎn)移1mol電子 組卷:22引用:4難度:0.7 -
10.Cu2S與一定濃度的HNO3反應(yīng),生成Cu(N O3 )2、CuSO4、NO2、NO和H2O.當(dāng)NO2和NO的體積相等時(shí),實(shí)際參加反應(yīng)的Cu2S與HNO3的物質(zhì)的量之比為( )
A.1:7 B.1:5 C.1:9 D.2:9 組卷:204引用:10難度:0.9
三、實(shí)驗(yàn)題
-
29.某種食用精制鹽包裝袋上有如表說明:
(1)碘酸鉀與碘化鉀在酸性條件下發(fā)生如下反應(yīng),配平化學(xué)方程式(將化學(xué)計(jì)量數(shù)填于空白處)產(chǎn)品標(biāo)準(zhǔn) GB5461 產(chǎn)品等級(jí) 一級(jí) 配 料 食鹽、碘酸鉀、抗結(jié)劑 碘含量(以I計(jì)) 20~50mg/kg 分裝時(shí)期 分裝企業(yè) KIO3+KI+H2SO4═K2SO4+I2+H2O
(2)上述反應(yīng)生成的I2可用四氯化碳檢驗(yàn).向碘的四氯化碳溶液中加入Na2SO3稀溶液,將I2還原,以回收四氯化碳.
①Na2SO3稀溶液與I2反應(yīng)的離子方程式是.
②某學(xué)生設(shè)計(jì)回收四氯化碳的操作為:
a.將碘的四氯化碳溶液置于分液漏斗中;
b.加入適量Na2SO3稀溶液;
c.分離出下層液體d.將分液漏斗充分振蕩后靜置
其中分液漏斗使用前須進(jìn)行的操作是,上述操作正確的順序是:(填序號(hào))
(3)已知:I2+2S2O32-═2I-+S4O62-.某學(xué)生測(cè)定食用精制鹽的碘含量,其步驟為:
a.準(zhǔn)確稱取wg食鹽,加適量蒸餾水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3與KI反應(yīng)完全;
c.以淀粉為指示劑,逐滴加入物質(zhì)的量濃度為2.0×10-3mol?L-1的Na2S2O3溶液10.0mL,恰好反應(yīng)完全.
①判斷c中反應(yīng)恰好完全依據(jù)的現(xiàn)象是.
②b中反應(yīng)所產(chǎn)生的I2的物質(zhì)的量是mol.
③根據(jù)以上實(shí)驗(yàn)和包裝袋說明,所測(cè)精制鹽的碘含量是(以含w的代數(shù)式表示)mg/kg.組卷:158引用:6難度:0.5 -
30.高氯酸銨可用于火箭推進(jìn)劑,實(shí)驗(yàn)室可由NaClO.等原料制取(部分物質(zhì)溶解度如圖1),其實(shí)驗(yàn)流程如下:

(1)氯酸鈉受熱分解生成高氯酸鈉和氯化鈉的化學(xué)方程式為.
(2)80℃時(shí)浸取液冷卻至0℃過濾,濾渣的主要成分為(寫化學(xué)式).
(3)反應(yīng)器中加入氯化銨飽和溶液發(fā)生反應(yīng)的離子方程式為.
(4)已知:2NH4ClO4N2↑+2O2↑+Cl2↑+4H2O,現(xiàn)可提供下列試劑:△
a.飽和食鹽水 b.濃H2SO4 c.NaOH溶液 d.Mg e.Cu f.Fe
利用如圖2裝置對(duì)高氯酸銨熱分解產(chǎn)生的三種氣體進(jìn)行分別吸收或收集.
①E中收集到的氣體可能是(填化學(xué)式).
②A、B、C中盛放的藥品依次可以是(選填:I、Ⅱ、Ⅲ).
I.a(chǎn)、b、dⅡ.c、b、eⅢ.b、c、f
(5)過濾用到的主要玻璃儀器是.組卷:63引用:5難度:0.3


