2021-2022學(xué)年遼寧省沈陽(yáng)市鐵西區(qū)重點(diǎn)協(xié)作校高二(上)期中化學(xué)試卷
發(fā)布:2024/12/21 10:30:2
一、選擇題:本題共15小題,每小題3分,共45分。在每小題給出的四個(gè)選項(xiàng)中,只有一個(gè)選項(xiàng)符合題目要求。
-
1.化學(xué)與生活息息相關(guān),下列說(shuō)法錯(cuò)誤的是( )
A.碳酸鈉可用于去除餐具的油污是利用了鹽類(lèi)水解的原理 B.草木灰和氯化銨不能混合使用是因?yàn)槎甙l(fā)生雙水解反應(yīng) C.冰箱能夠保存食物的最主要原因是冰箱可以殺滅細(xì)菌 D.打開(kāi)劇烈搖動(dòng)后的碳酸飲料產(chǎn)生大量氣泡的原因是壓強(qiáng)對(duì)化學(xué)平衡的影響 組卷:8引用:3難度:0.7 -
2.德國(guó)哈伯發(fā)明以低成本制造大量氨的方法,流程圖中為提高原料轉(zhuǎn)化率而采取措施是( )
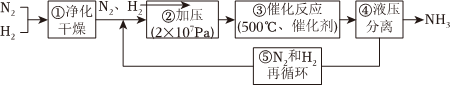
A.①②③ B.②④⑤ C.①③⑤ D.②③④ 組卷:208引用:13難度:0.7 -
3.將一定量純凈的氨基甲酸銨置于密閉真空容器中(假設(shè)容器體積不變,固體試樣體積忽略不計(jì)),在恒定溫度下使其達(dá)到分解平衡:H2NCOONH4(s)?2NH3(g)+CO2(g)。能判斷該反應(yīng)已達(dá)到化學(xué)平衡的是( )
①v(NH3)正=2v(CO2)逆
②密閉容器中總壓強(qiáng)不變
③密閉容器中混合氣體的密度不變
④密閉容器中混合氣體的平均相對(duì)分子質(zhì)量不變
⑤密閉容器中n(NH3):n(CO2)=2:1
⑥混合氣體總質(zhì)量不變A.①②③⑥ B.①②④⑥ C.①③④⑤ D.全部 組卷:27引用:6難度:0.6 -
4.人體血液內(nèi)的血紅蛋白(Hb)易與O2結(jié)合生成HbO2,因此具有輸氧能力,CO吸入肺中發(fā)生反應(yīng):CO+HbO2?O2+HbCO,37℃時(shí),該反應(yīng)的平衡常數(shù)K=220.HbCO的濃度達(dá)到HbO2濃度的0.02倍,會(huì)使人智力受損。據(jù)此,下列結(jié)論錯(cuò)誤的是( )
A.CO與HbO2反應(yīng)的平衡常數(shù) K=c(O2)?c(HbCO)c(CO)?c(HbO2)B.人體吸入的CO越多,與血紅蛋白結(jié)合的O2越少 C.當(dāng)吸入的CO與O2濃度之比大于或等于0.02時(shí),人的智力才會(huì)受損 D.把CO中毒的病人放入高壓氧倉(cāng)中解毒,其原理是使上述平衡向左移動(dòng) 組卷:313引用:43難度:0.7 -
5.下列敘述不正確的是( )
A.碳酸氫鈉加熱可以分解,因?yàn)樯邷囟壤陟卦龅姆较蜃园l(fā)進(jìn)行 B.在溫度、壓強(qiáng)一定的條件下,自發(fā)反應(yīng)總是向△G=△H-T△S<0的方向進(jìn)行 C.水結(jié)冰的過(guò)程不能自發(fā)進(jìn)行的原因是熵減的過(guò)程,改變條件也不可能自發(fā)進(jìn)行 D.混亂度減小的吸熱反應(yīng)一定不能自發(fā)進(jìn)行 組卷:13引用:6難度:0.7 -
 6.在某密閉容器中發(fā)生:2SO2(g)+O2(g)?2SO3(g),反應(yīng)混合體系在平衡狀態(tài)時(shí)SO3的百分含量與溫度的關(guān)系如圖所示。下列說(shuō)法正確的是( )
6.在某密閉容器中發(fā)生:2SO2(g)+O2(g)?2SO3(g),反應(yīng)混合體系在平衡狀態(tài)時(shí)SO3的百分含量與溫度的關(guān)系如圖所示。下列說(shuō)法正確的是( )A.在D點(diǎn)時(shí)v正<v逆 B.反應(yīng)2SO2(g)+O2(g)?2SO3(g)的焓變△H>0 C.恒溫恒壓下向平衡體系中通入氦氣,平衡向左移動(dòng) D.若B、C點(diǎn)的平衡常數(shù)分別為KB、KC,則KB=KC 組卷:17引用:1難度:0.7 -
7.NA表示阿伏加德羅常數(shù)的值,下列說(shuō)法正確的是( )
A.常溫下,pH=1的硫酸溶液中,含有H+數(shù)目為0.1NA B.常溫下,1L0.5mol?L-1的AlCl3溶液中,含有Al3+數(shù)目為0.5NA C.常溫下,1LpH=12的CH3COONa溶液,由水電離產(chǎn)生的OH-數(shù)目為10-12NA D.標(biāo)準(zhǔn)狀況下,4.48LNH3溶于水得到的溶液中,NH3?H2O和NH4+的總數(shù)小于0.2NA 組卷:21引用:2難度:0.5
二、主觀題,共55分
-
20.滴定實(shí)驗(yàn)是化學(xué)學(xué)科中重要的定量實(shí)驗(yàn)。請(qǐng)回答下列問(wèn)題:
(1)酸堿中和滴定:用標(biāo)準(zhǔn)鹽酸滴定未知濃度的NaOH溶液。
①酸式滴定管、堿式滴定管、溫度計(jì)、量筒、玻璃棒、燒杯。若要進(jìn)行中和滴定實(shí)驗(yàn),還缺少的玻璃儀器是。
②若在接近滴定終點(diǎn)時(shí),用少量蒸餾水將錐形瓶?jī)?nèi)壁沖洗一下,再繼續(xù)滴定至終點(diǎn),則所測(cè)得NaOH溶液濃度( 填“偏大”、“偏小”或“無(wú)影響”)。
(2)氧化還原滴定:用標(biāo)準(zhǔn)高錳酸鉀溶液滴定未知濃度的草酸(H2C2O4)溶液。取草酸溶液置于錐形瓶中,加入適量稀硫酸,用濃度為0.1000mol?L-1的高錳酸鉀溶液滴定
①寫(xiě)出該反應(yīng)的化學(xué)方程式,滴定時(shí),KMnO4溶液應(yīng)裝在(“酸”或“堿”)式滴定管中,判定滴定終點(diǎn)方法為。
②表格中記錄了實(shí)驗(yàn)數(shù)據(jù):
該草酸溶液的物質(zhì)的量濃度為滴定次數(shù) 待測(cè)液體積(mL) 標(biāo)準(zhǔn)KMnO4溶液(mL) 滴定前讀數(shù) 滴定后讀數(shù) 第一次 25.00 0.50 20.40 第二次 25.00 3.00 23.00 第三次 25.00 4.00 24.10 。
(3)Mohr法是沉淀滴定法中常用的銀量法的一種滴定終點(diǎn)的確定方法。在化學(xué)分析中采用K2CrO4為指示劑,以AgNO3標(biāo)準(zhǔn)溶液滴定溶液中Cl-,利用Ag+與CrO42-生成磚紅色沉淀,指示到達(dá)滴定終點(diǎn).當(dāng)溶液中Cl-恰好沉淀完全(濃度等于1.0×10-6mol?L-1)時(shí),溶液中c(Ag+)為mol?L-1,此時(shí)溶液中c(CrO42-)等于mol?L-1。(已知Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgCl)=2.0×10-10)。組卷:46引用:3難度:0.7 -
21.采用廢鐵屑還原軟錳礦(軟錳礦主要成分是MnO2,還含有Fe2O3、MgO、SiO2和NiCO3雜質(zhì))來(lái)制備Mn的工藝流程如圖所示。

已知:①Ksp(MnS)=2.6×10-10,Ksp(NiS)=2.0×10-21;②生成氫氧化物的pH見(jiàn)下表
回答下列問(wèn)題:離子 Fe2+ Fe3+ Mg2+ Ni2+ Mn2+ 開(kāi)始沉淀的pH 7.5 2.7 8.1 7.7 8.3 完全沉淀的pH 9.7 3.7 9.4 8.4 9.8
(1)“酸浸”前將原料粉碎的目的是。
(2)加入量MnO2的目的是。
(3)常溫下,已知K(NH3?H2O)=4×10-5,則0.1mol/L的NH3?H2O的pH約為(lg2=0.3)。
(4)“調(diào)節(jié)pH”操作中pH控制范圍為。
(5)“除雜”加入MnS,請(qǐng)寫(xiě)出此過(guò)程發(fā)生的離子方程式:。當(dāng)該反應(yīng)完成后,濾液中的Mn2+和Ni2+的物質(zhì)的量濃度之比是。
(6)“沉錳”過(guò)程中溫度和pH對(duì)Mn2+和Mg2+沉淀率的影響如圖所示。由圖可知,“沉錳”的合適條件是。 組卷:17引用:2難度:0.3
組卷:17引用:2難度:0.3


