2022-2023學年山東省青島市萊西市高二(上)期中化學試卷(學業水平一)
發布:2024/9/12 2:0:8
一、本大題共10小題,每小題2分,共20分。在每小題列出的四個選項中,只有一項符合題目要求。
-
1.在溫熱氣候條件下,淺海地區有厚層的石灰石沉積,而深海地區卻很少。下列解析不正確的是( )
A.與深海地區相比,淺海地區水溫較高,有利于游離的CO2增多、石灰石沉積 B.與淺海地區相比,深海地區壓強大,石灰石巖層易被CO2溶解,沉積少 C.深海地區石灰石巖層的溶解反應為:CaCO3(s)+H2O(l)+CO2(aq)═Ca(HCO3)2(aq) D.海水里弱酸性,大氣中CO2濃度增加,會導致海水中CO32-濃度增大 組卷:617引用:7難度:0.5 -
2.據報道,加拿大科學家發明了一種特殊的“電催化劑”,該新型“電催化劑”是一種用于電解器中催化水分解為氫氣與氧氣的多孔金屬氧化物固體。下列有關該催化劑的說法正確的是( )
A.使用該催化劑,能減小水分解反應的焓變 B.該催化劑的使用可提高水的分解率 C.金屬氧化物固體的多孔結構,可提高催化劑的催化效率 D.該催化劑還可以作其他所有液態化合物分解反應的催化劑 組卷:132引用:5難度:0.7 -
3.化學反應進行的方向是一個比較復雜的問題。下列有關說法正確的是( )
A.反應SO3(g)+H2O(1)═H2SO4(1)的ΔS>0 B.1molCO2在不同狀態時的熵值:S[CO2(g)]<S[CO2(s)] C.反應2N2O5(g)═4NO2(g)+O2(g) ΔH>0能否自發進行與溫度有關 D.ΔH<0或ΔS>0的反應一定能自發進行 組卷:25引用:8難度:0.5 -
 4.z下列關于如圖所示轉化關系(X代表鹵素)的說法不正確的是( )
4.z下列關于如圖所示轉化關系(X代表鹵素)的說法不正確的是( )A.ΔH3<0 B.ΔH1+ΔH2+ΔH3=0 C.按照Cl、Br、I的順序,ΔH2依次減少 D.一定條件下,拆開1mol氣態HX需要吸收akJ能量,則該條件下ΔH3=-2akJ/mol 組卷:20引用:2難度:0.7 -
5.某興趣小組探究金屬腐蝕條件,設計了以下實驗裝置。下列說法不正確的是( )
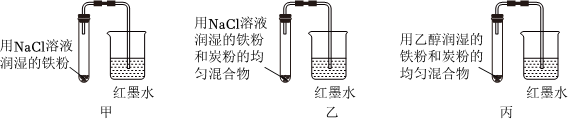
A.鐵粉腐蝕速率:乙>甲>丙 B.甲、乙、丙三個裝置均構成原電池,發生吸氧腐蝕 C.乙裝置發生電化學腐蝕時正極反應式:O2+2H2O+4e-═4OH- D.對比甲、乙、丙三個實驗,金屬放在有些有機溶劑中可防腐蝕 組卷:8引用:1難度:0.5 -
 6.工業上氟氣可作為火箭燃料中的氧化劑。1886年法國化學家H?Moissan通過電解氟氫化鉀(KHF2)的氟化氫無水溶液第一次制得氟氣。已知:HF+HF═KHF2,制備氟氣的電解裝置如圖所示。下列說法錯誤的是( )
6.工業上氟氣可作為火箭燃料中的氧化劑。1886年法國化學家H?Moissan通過電解氟氫化鉀(KHF2)的氟化氫無水溶液第一次制得氟氣。已知:HF+HF═KHF2,制備氟氣的電解裝置如圖所示。下列說法錯誤的是( )A.鋼電極與電源的負極相連 B.氟氫化鉀在氟化氫中可以電離 C.陰極室與陽極室必須隔開 D.電解過程需不斷補充的X是KF 組卷:11引用:3難度:0.7
三、非選擇題,本題共5個小題,共60分。
-
19.二氧化硫的催化氧化是工業上生產硫酸的主要反應,反應如下:
已知:2SO2(g)+O2(g)?2SO3(g)ΔH=-196kJ?mol-1
(1)為研究該反應,某同學設計了如圖所示的三種密閉容器裝置(已裝入固體V2O3催化劑)。
在初始體積與溫度相同的條件下,甲、乙、丙三個容器中均按2molSO2、1molO2進行投料,達到平衡時,三個容器中SO2的轉化率由大到小的順序為(用“甲”“乙”“丙”表示)。
(2)在恒溫恒壓下不能說明該反應已達平衡的是(填序號)。
①v正(SO3)=2v逆(O2)
②n(SO3):n(O2):n(SO2)=2:1:2
③混合氣體的平均相對分子質量不再改變
④氧氣的平衡分壓不再改變
(3)某溫度,在一個固定容積為5L的密閉容器中充入0.20molSO2和0.10molO2,t1時刻達到平衡,測得容器中含SO3(g)0.18mol。
①計算該溫度下,平衡常數K=。
②t1時刻達到平衡后,改變一個條件使化學反應速率發生如圖所示的變化,則改變的條件是。
A.體積不變,向容器中通入少量氮氣
B.體積不變,向容器中通入少量SO2
C.縮小容器體積
D.升高溫度
③若繼續通入0.02molSO3和0.010molO2,則平衡移動(填“向正反應方向”、“向逆反應方向”或“不”)。
(4)當SO2(g)、O2(g)和N2(g)起始的物質的量分數分別為7.5%、10.5%和82%時,在0.5MPa、2.5MPa和5.0MPa壓強下,SO2平衡轉化率α隨溫度的變化如圖所示。
反應在5.0MPa、550℃時的α=。判斷的依據是。組卷:8引用:1難度:0.5 -
20.我國力爭2060年前實現碳中和。CH,與CO2催化重整是實現碳中和的熱點研究課題。該催化重整反應體系主要涉及以下反應:
反應Ⅰ:主反應CH4(g)+CO2(g)?2CO(g)+2H2(g)ΔH1Kp1
反應Ⅱ:副反應CO2(g)+H2(g)?CO(g)+H2O(g)ΔH2Kp2
反應Ⅲ:積碳反應2CO(g)?CO2(g)+C(s)ΔH3Kp3
反應Ⅳ:積碳反應CH4(g)?C(s)+2H2(g)ΔH4Kp4
(1)已知H2(g)、CO(g)的燃燒熱ΔH分別為-285.8kJ?mol-1、-283.01kJ?mol-1,H2O(l)═H2O(g)ΔH5=+44kJ?mol-1,則反應Ⅱ的ΔH2=kJ?mol-1。
(2)下列關于該重整反應體系的說法正確的是。
A.在投料時適當增大的值,有利于減少積碳n(CO2)n(CH4)
B.在一定條件下建立平衡后,移去部分積碳,反應Ⅲ和反應Ⅳ平衡均向右移
C.隨著投料比的增大,達到平衡時CH4的轉化率增大n(CO2)n(CH4)
D.降低反應溫度,反應Ⅰ、Ⅱ、Ⅳ的正反應速率減小,逆反應速率增大;反應Ⅲ的正反應速率增大,逆反應速率減小
(3)對于反應Ⅰ:主反應CH4(g)+CO2(g)?2CO(g)+2H2(g)在pMPa時,將CO2和CH4按物質的量之比為1:1充入密閉容器中,分別在無催化劑及ZrO2催化下反應相同時間,測得CO2的轉化率與溫度的關系如圖所示:
①a點CO2轉化率相等的原因是。
②在pMPa、900℃、ZrO2催化條件下,將CO2、CH4、H2O按物質的量之比為1:1:n充入催化劑密閉容器,CO2的平衡轉化率α大于50%,解釋說明原因,此時平衡常數。Kp=(以分壓表示,分壓=總壓×物質的量分數:寫出含α、n、p的計算表達式)。
(4)以NaCl飽和溶液為電解質溶液,利用如圖所示的裝置將CO2轉化為燃料CO。則電極Ⅱ接電源的極,陰極上電極反應式為。 組卷:8引用:1難度:0.4
組卷:8引用:1難度:0.4


