2018-2019學年北京二十二中高三(上)期中化學試卷
發布:2024/4/20 14:35:0
一.單項選擇題(下列各小題中只有一個選項符合題意,共51分,每小題3分)
-
1.下列我國科技成果所涉及物質的應用中,發生的不是化學變化的是( )




A.甲醇低溫所制氫氣用于新能源汽車 B.氘、氚用作“人造太陽”核聚變燃料 C.偏二甲肼用作發射“天宮二號”的火箭燃料 D.開采可燃冰,將其作為能源使用 A.A B.B C.C D.D 組卷:980引用:22難度:0.5 -
2.用化學用語表示NH3+HCl═NH4Cl中的相關微粒,其中正確的是( )
A.中子數為8的氮原子: N87B.HCl的電子式: 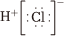
C.NH3的結構式: 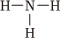
D.Cl-的結構示意圖: 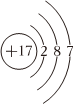 組卷:1142引用:31難度:0.9
組卷:1142引用:31難度:0.9 -
3.下列有關膠體的說法不正確的是( )
A.膠體均為無色透明的液體 B.利用丁達爾效應可以區分膠體和溶液 C.膠體中分散質粒子的直徑在1~100 nm之間 D.向沸水中逐滴加入少量FeCl3飽和溶液,可制得Fe(OH)3膠體 組卷:12引用:3難度:0.9 -
4.Lv(中文名“
 ”,lì)是元素周期表第116號元素,Lv的原子核外最外層電子數是6.下列說法中,不正確的是( )
”,lì)是元素周期表第116號元素,Lv的原子核外最外層電子數是6.下列說法中,不正確的是( )A.Lv的原子半徑比S的原子半徑大 B. Lv的原子核內有293個中子293116C.Lv位于元素周期表第七周期第ⅥA族 D. Lv、290116Lv、291116Lv互為同位素292116組卷:180引用:3難度:0.9 -
5.下列說法正確的是( )
A.1 mol NH3中含有的質子數約為6.02×1023 B.0.5 mol?L-1 NaCl溶液中含Cl-的物質的量為0.5 mol C.8 g S在足量O2中完全燃燒轉移的電子數約為9.03×1023 D.標準狀況下,22.4 L SO2和CO2的混合氣體所含原子數約為1.806×1024 組卷:45引用:5難度:0.7 -
 6.中國科學院科研團隊研究表明,在常溫常壓和可見光下,基于LDH(一種固體催化劑)合成NH3的原理示意圖如圖。下列說法不正確的是
6.中國科學院科研團隊研究表明,在常溫常壓和可見光下,基于LDH(一種固體催化劑)合成NH3的原理示意圖如圖。下列說法不正確的是
( )A.該過程將太陽能轉化為化學能 B.該過程中,只涉及極性鍵的斷裂與生成 C.氧化劑與還原劑的物質的量之比為1:3 D.原料氣N2可通過分離液態空氣獲得 組卷:130引用:12難度:0.8 -
7.下列事實中,不能用元素周期律解釋的是( )
A.原子半徑:K>Ca>Mg B.堿性:NaOH>Mg(OH)2>Al(OH)3 C.熱穩定性:HF>HCl>H2S D.酸性:H2SO3>H2CO3>H2SiO3 組卷:46引用:6難度:0.7
二.填空題(共49分)
-
20.圖1所示的氮循環是生態系統物質循環的重要組成部分,人類活動加劇了氮循環中的物質轉化。

(1)結合圖1判斷下列說法正確的是(填字母序號)。
A.固氮過程中,N2只作氧化劑
B.在硝化細菌作用下發生的硝化過程需要有氧化劑參與
C.反硝化過程有助于彌補人工固氮對氮循環造成的影響
D.同化、氨化過程中,氮元素均從無機物轉移至有機物
(2)硝化過程中,NH3轉化成HNO2的反應的化學方程式為。
(3)反硝化過程中,CH3OH可作為反應的還原劑,請將該反應的離子方程式補充完整:
5CH3OH+6NO-3□N2↑+4反硝化細菌+□HCO-3+□
(4)利用表數據進行估算,寫出工業合成氨反應的熱化學方程式:。
(5)電解法合成氨因其原料轉化率大幅度提高,有望代替傳統的工業合成氨工藝。電解法合成氨的兩種原理及裝置如圖2和圖3所示。共價鍵 N≡N H-H N-H 斷開1mol共價鍵所需能量(KJ) 946 436 391
①圖2中,A電極上通入的X為。
②圖3中,D電極上的電極反應式為。
③若圖2和圖3裝置的通電時間相同、電流強度相等,電解效率分別為80%和60%,則兩種裝置中產生氨氣的物質的量之比為。組卷:110引用:3難度:0.5 -
21.苯甲酸是常用的防腐劑和重要的醫藥原料。一種藥用苯甲酸的制備方法如下:
Ⅰ.在反應罐中加入甲苯、飽和KMnO4溶液、Fe2O3(催化劑),加熱、回流數小時,充分反應。
Ⅱ.反應結束后,改為蒸餾裝置。加熱蒸餾,直至冷凝管壁不再出現油珠。
Ⅲ.將反應罐中的混合物趁熱過濾,濾渣用少量熱水洗滌。
Ⅳ.向濾液中滴加濃鹽酸酸化至pH=2,抽濾,用少量水洗滌,干燥得苯甲酸粗品。
Ⅴ.將粗苯甲酸加入…,結晶、洗滌、過濾,得到藥用純苯甲酸。
已知:相關物質的溶解度(g/mL)
(1)Ⅰ中發生的主要反應為:溫度(℃) 25 50 60 苯甲酸 在水中 0.0034 0.0085 0.0095 在乙醇中 0.4 0.7 1 氯化鉀 在乙醇中 難溶  +KMNO4Fe2O3
+KMNO4Fe2O3 +KOH+MnO2+H2O(未配平),則Ⅳ中發生反應的離子方程式為。
+KOH+MnO2+H2O(未配平),則Ⅳ中發生反應的離子方程式為。
(2)Ⅱ中蒸餾的目的是。
(3)Ⅲ中趁熱過濾的目的是。
(4)將Ⅴ中操作補充完整:。組卷:45引用:4難度:0.6


