2022-2023學年廣東省深圳中學高二(上)期中化學試卷
發(fā)布:2024/4/20 14:35:0
一、單項選擇題(每小題只有一個答案符合題意,共16小題,1-10小題每小題3分,11-16小題每小題3分,共54分)
-
1.下列既是氧化還原反應,又是放熱反應的是( )
A.碳和二氧化碳在高溫下的反應 B.碳酸鈣高溫分解 C.氫氧化鈉和鹽酸的反應 D.鋁片和稀硫酸的反應 組卷:22引用:4難度:0.7 -
 2.某反應A(g)+3B(g)═2C(g)的能量變化如圖所示,下列說法正確的是( )
2.某反應A(g)+3B(g)═2C(g)的能量變化如圖所示,下列說法正確的是( )A.反應物比生成物穩(wěn)定 B.該反應為吸熱反應 C.該反應在低溫下可以自發(fā)進行 D.溫度升高會降低該反應的正反應速率 組卷:31引用:2難度:0.6 -
3.下列溶液顯酸性的是( ){Ka[CH3COOH]═Kb[NH3?H2O]═1.8×10-5}
A.NaCl B.CH3COONa C.NH4Cl D.CH3COONH4 組卷:22引用:1難度:0.8 -
4.活性炭處理汽車尾氣的方法:C(s)+2NO(g)?N2(g)+CO2(g)。關于該反應說法不正確的是( )
A.該反應體現(xiàn)了NO的氧化性 B.降低NO濃度能夠減慢反應速率 C.加入足量的炭粉可以使NO100%轉(zhuǎn)化 D.合適的催化劑可以加快反應速率 組卷:15引用:1難度:0.8 -
 5.一定條件下,將3molX和1molY混合于2L恒容的密閉容器中,發(fā)生反應:3X(g)+Y(g)?Z(s)+2W(g)。2min末該反應達到平衡,生成W的物質(zhì)的量隨時間的變化情況如圖所示。下列判斷正確的是( )
5.一定條件下,將3molX和1molY混合于2L恒容的密閉容器中,發(fā)生反應:3X(g)+Y(g)?Z(s)+2W(g)。2min末該反應達到平衡,生成W的物質(zhì)的量隨時間的變化情況如圖所示。下列判斷正確的是( )A.當混合氣體的密度不再改變時,該反應達到平衡狀態(tài) B.0-2min用Z表示的反應速率為0.2mol?L-1?min-1 C.從1min到2min過程中,氣體的壓強沒有變化 D.反應過程中X和Y的轉(zhuǎn)化率之比為3:1 組卷:73引用:5難度:0.4 -
6.關于下列各實驗或裝置的敘述中,正確的是( )
A. 
①是利用pH試紙測定稀硫酸的pH值B. 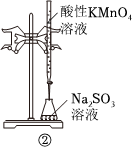
②是用酸性KMnO4溶液滴定Na2SO3溶液C. 
③是標準鹽酸滴定待測氫氧化鈉時手的操作D. 
④是酸式滴定管排氣泡的操作組卷:15引用:5難度:0.5
二、非選擇題(共4小題,共46分。若無特殊說明,每空2分)
-
19.NH4Al(SO4)2、NH4HSO4在分析試劑、醫(yī)藥、電子工業(yè)中用途廣泛。請回答下列問題:
(1)常溫時,0.1mol?L-1NH4Al(SO4)2溶液的pH═3。
①溶液中由水電離出的c(H+)=mol?L-1。
②溶液中c()+c(NH3?H2O)NH+4c(Al3+)+c[Al(OH)3](填“>”“═”或“<”);2c()-c(SO2-4)-3c(Al3+)=NH+4mol?L-1(填精確計算式,無需計算出結(jié)果)。
(2)80℃時,0.1mol?L-1NH4Al(SO4)2溶液的pH小于3,分析導致pH隨溫度變化的原因是。
(3)常溫時,向100mL0.1mol?L-1NH4HSO4溶液中滴加0.1mol?L-1NaOH溶液,得到的溶液pH與NaOH溶液體積的關系曲線如圖所示。
①圖中a、b、c、d四點中水的電離程度最大的是。
②向NH4HSO4溶液中滴加NaOH溶液從a點到d點的過程中,發(fā)生反應的離子方程式。
③NH4HSO4溶液中各離子濃度由大到小的排列順序是。組卷:39引用:1難度:0.7 -
20.納米氧化鋅可作為一些催化劑的載體,二氧化錳也常作催化劑、氧化劑與去極化劑,用途非常廣泛。工業(yè)上由軟錳礦(主要成分為MnO2)與鋅精礦(主要成分為ZnS)酸性共溶法制備MnO2,及納米ZnO,工藝流程如圖:
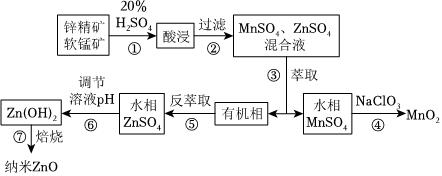
請回答下列問題:
(1)實驗室完成步驟③所用到的主要玻璃儀器是(填寫名稱)。
(2)完成步驟④中發(fā)生反應的離子方程式:。
(3)經(jīng)⑤所得水相再經(jīng)過蒸發(fā)濃縮、冷卻結(jié)晶、過濾等操作得到ZnSO4?7H2O。
已知:(ⅰ)工業(yè)條件下,部分金屬陽離子Mn+開始沉淀和完全沉淀時的pH值如圖:
通常溶液中離子濃度小于1×10-5mol?L-1,則認為完全沉淀。
(ⅱ)相關常數(shù):Ksp(ZnS)═2.1×10-22,Ka1(H2S)═1.0×10-7,Ka2(H2S)═7.0×10-15,Ka(CH3COOH)═1.8×10-5。
①對于含有Fe3+、Cu2+、Fe2+雜質(zhì)的Zn2+溶液,可以通過調(diào)節(jié)溶液pH值除去的離子是;
A.Fe3+與Cu2+
B.Cu2+與Fe2+
C.僅有Fe2+
D.僅有Fe3+
此時須將溶液的pH值調(diào)節(jié)到(填寫pH值范圍)。
②制得ZnSO4?7H2O后最終殘留的酸性廢液中含有ZnSO4,除去酸性廢液中Zn2+的方法是:在酸性廢液中加入一定量CH3COONa后,再通入H2S生成ZnS沉淀。處理后的溶液中部分微粒濃度為:
測:處理后的溶液中c(Zn2+)═微粒 H2S CH3COOH CH3COO- 濃度(mol?L-1) 0.10 0.10 0.18 mol?L-1。
(4)ZnSO4?7H2O產(chǎn)品的純度可用配位滴定法測定。下列關于滴定分析,正確的是。
A.滴定前,錐形瓶和滴定管均須用標準溶液潤洗
B.將標準溶液裝入滴定管時,應借助燒杯或漏斗等玻璃儀器轉(zhuǎn)移
C.滴定終點時,讀取標準液體積時俯視滴定管液面,則測得的體積比實際消耗的小
D.滴定前滴定管尖嘴內(nèi)有氣泡,滴定后尖嘴內(nèi)無氣泡,則測得的體積比實際消耗的大組卷:16引用:1難度:0.4


