2022-2023學年甘肅省張掖市高臺一中高三(上)期中化學試卷
發布:2024/11/18 18:0:2
一、選擇題:本題共14小題,每小題3分,共42分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.下列過程的現象與氧化還原反應有關的是( )
A.氨遇氯化氫氣體,產生白煙 B.銅片投入濃硝酸中,產生紅棕色氣體 C.向FeCl3溶液中滴入KSCN溶液后,溶液變為紅色 D.向NaCl溶液中滴入HNO3酸化的AgNO3溶液,產生白色沉淀 組卷:12引用:1難度:0.8 -
2.下列從海洋中獲取物質的方案不合理的是( )
A.粗鹽先通過除雜、精制得到飽和食鹽水,然后電解得到氯氣,最后和石灰乳反應制得漂白粉 B.苦鹵酸化后通入氯氣得到溴水,然后用熱空氣將其通入到SO2水溶液中,最后通入氯氣后蒸餾得粗溴 C.干海帶灼燒后加水浸取,然后加入H2O2得到碘水,最后通過萃取、分液、蒸餾得到碘單質 D.向海水中加入石灰乳得到Mg(OH)2,加入鹽酸得到MgCl2溶液,最后電解該溶液得到鎂單質 組卷:58引用:5難度:0.7 -
3.利用反應2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.8kJ?mol-1,可凈化汽車尾氣,如果要同時提高該反應的速率和NO的轉化率,采取的措施是( )
A.降低溫度 B.增大壓強同時加催化劑 C.升高溫度同時充入N2 D.及時將CO2和N2從反應體系中移走 組卷:89引用:14難度:0.6 -
4.下列關于化學反應的速率和限度的說法不正確的是( )
A.任何可逆反應都有一定的限度 B.影響化學反應速率的條件有溫度、催化劑、濃度等 C.化學平衡狀態指的是反應物和生成物濃度相等時的狀態 D.決定化學反應速率的主要因素是物質本身的性質 組卷:28引用:9難度:0.7 -
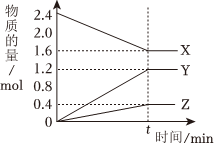 5.一定溫度下,在容積為2L的恒容密閉容器中,某一反應中X、Y、Z三種氣體的物質的量隨時間變化的曲線如圖所示。下列表述中正確的是( )
5.一定溫度下,在容積為2L的恒容密閉容器中,某一反應中X、Y、Z三種氣體的物質的量隨時間變化的曲線如圖所示。下列表述中正確的是( )A.反應的化學方程式為2X═3Y+Z B.tmin時,正、逆反應都不再繼續進行,反應達到化學平衡 C.若t=4,則0~4min內用X表示的化學反應速率為0.1mol?L-1?min-1 D.溫度、體積不變,tmin時充入1molHe使壓強增大,正、逆反應速率都增大 組卷:14引用:1難度:0.5 -
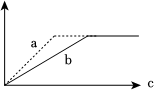 6.已知反應3A(g)+B(g)?C(s)+4D(g)(正反應放熱),如圖中a,b表示一定條件下,D的體積分數隨時間t的變化情況。若要使曲線b變為曲線a,可采取的措施是:
6.已知反應3A(g)+B(g)?C(s)+4D(g)(正反應放熱),如圖中a,b表示一定條件下,D的體積分數隨時間t的變化情況。若要使曲線b變為曲線a,可采取的措施是:
①增大B的濃度②升高反應溫度③縮小反應容器的體積(加壓)④加入催化劑( )A.①② B.①③ C.②③ D.③④ 組卷:28引用:11難度:0.7
二、非選擇題:本題共5小題,共58分。
-
18.25℃時,在容積為2L的密閉容器中,氣態物質A、B、C的物質的量n(mol)隨時間t的變化如圖所示,已知達到平衡后,降低溫度,A的轉化率增大。
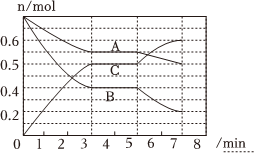
(1)根據上圖數據,寫出該反應的化學方程式:。此反應的平衡常數的表達式K=[用含c(A)、c(B)、c(C)的代數式表示],從反應開始到第一次平衡時的平均速率v(A)=。
(2)在5~7min內,若K值不變,則此處曲線變化的原因是。
(3)下圖表示此反應的反應速率v和時間t的關系圖: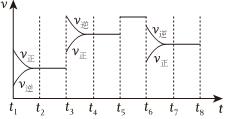
各階段的平衡常數如下表所示:
K1、K2、K3、K4之間的關系為t2~t3 t4~t5 t5~t6 t7~t8 K1 K2 K3 K4 (用“>”“<”或“=”連接)。A的轉化率最大的一段時間是。組卷:7引用:1難度:0.5 -
19.某小組研究發現某條件下可實現乙醛的分解,其熱化學方程式為CH3CHO(g)?CH4(g)+CO(g)ΔH。回答下列問題:
(1)已知幾種共價鍵的鍵能如下:
上述反應的ΔH=共價鍵 C-H C-C C=O C≡O 鍵能/(kJ?mol-1) 413 347 745 958.5 kJ?mol-1。
(2)上述正反應速率方程為v=kcn(CH3CHO)(k為速率常數,與溫度、催化劑有關)。實驗測得CH3CHO的反應速率與濃度關系如表所示:
①上述速率方程中,n=c(CH3CHO)/(mol?L-1) 0.1 0.2 0.3 0.4 v/(mol?L-1?s-1) 0.020 0.081 0.182 0.318 (n為整數)。
②c(CH3CHO)=0.15mol?L-1時,正反應速率為。
③下列有關說法正確的是(填字母)。
A.升高溫度,k增大;加催化劑,k減小
B.升高溫度,k減小;加催化劑,k增大
C.降低溫度,k減小;加催化劑,k增大
D.降低溫度,k增大;加催化劑,k減小
(3)在一定溫度下,向恒容密閉容器中充入1molCH3CHO(g),在一定條件下達到平衡。
①下列情況表明上述反應達到平衡狀態的是(填字母)。
A.保持不變c(CH4)?c(CO)c(CH3CHO)
B.混合氣體密度保持不變
C.氣體壓強保持不變
D.CH4消耗速率等于CH3CHO生成速率
②平衡后再充入少量乙醛,平衡(填“向左”“向右”或“不”)移動,達到新平衡時乙醛的平衡轉化率(填“增大”“減小”或“不變”)。
(4)一定溫度下,向某密閉容器中充入適量CH3CHO(g),測得CH3CHO的轉化率與壓強的關系如圖所示。當壓強為4MPa時,該反應的平衡常數Kp=(結果保留三位有效數字且帶單位)。(提示:用各物質分壓計算的平衡常數為Kp,分壓=總壓×物質的量分數)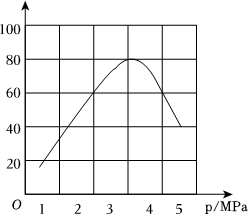 組卷:12引用:1難度:0.5
組卷:12引用:1難度:0.5


