2021-2022學(xué)年山東省臨沂市蘭陵縣高二(上)期中化學(xué)試卷
發(fā)布:2024/11/11 10:0:2
一、選擇題:本題共10小題,每小題2分,共20分.每小題只有一個(gè)選項(xiàng)符合題意.
-
1.下列說法或表示方法正確的是( )
A.等質(zhì)量的硫蒸氣和硫固體分別完全燃燒,后者放出的能量多 B.由C(石墨)→C(金剛石)△H=+119kJ?mol-1可知,金剛石比石墨穩(wěn)定 C.在101kPa時(shí),2gH2完全燃燒生成液態(tài)水,放出285.8kJ熱量,則H2燃燒熱的化學(xué)方程式表示為:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1 D.在稀溶液中,H+(aq)+OH-(aq)═(H2O)(l)△H=-57.3kJ?mol-1,若將含0.5mol H2SO4的濃硫酸與含1mol NaOH的溶液混合,放出的熱量大于57.3kJ 組卷:45引用:23難度:0.9 -
2.化學(xué)家格哈德?埃特爾證實(shí)了氫氣與氮?dú)庠诠腆w催化劑表面合成氨的反應(yīng)過程,示意圖如下:
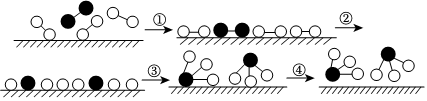
下列關(guān)于合成氨反應(yīng)的敘述中不正確的是( )A.該過程表明,在化學(xué)反應(yīng)中存在化學(xué)鍵的斷裂與形成 B.在催化劑的作用下,反應(yīng)物的化學(xué)鍵變得容易斷裂 C.過程②需吸收能量,過程③則放出能量 D.常溫下該反應(yīng)難以進(jìn)行,是因?yàn)槌叵律晌锏幕瘜W(xué)鍵難以形成 組卷:130引用:19難度:0.7 -
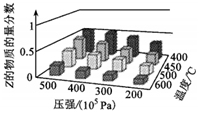 3.為了探索反應(yīng)條件對(duì)反應(yīng)aX(g)+bY(g)?cZ(g)的影響,以X和Y物質(zhì)的量比為a:b開始反應(yīng),通過實(shí)驗(yàn)得到不同條件下達(dá)到平衡時(shí)Z的物質(zhì)的量分?jǐn)?shù),實(shí)驗(yàn)結(jié)果如圖所示.以下判斷正確的是( )
3.為了探索反應(yīng)條件對(duì)反應(yīng)aX(g)+bY(g)?cZ(g)的影響,以X和Y物質(zhì)的量比為a:b開始反應(yīng),通過實(shí)驗(yàn)得到不同條件下達(dá)到平衡時(shí)Z的物質(zhì)的量分?jǐn)?shù),實(shí)驗(yàn)結(jié)果如圖所示.以下判斷正確的是( )A.正反應(yīng)放熱,a+b>c B.正反應(yīng)吸熱,a+b<c C.正反應(yīng)吸熱,a+b>c D.正反應(yīng)放熱,a+b<c 組卷:15引用:5難度:0.5 -
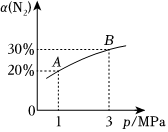 4.某溫度下,發(fā)生反應(yīng)N2(g)+3H2(g)?2NH3(g)ΔH=-92.4kJ?mol-1,N2的平衡轉(zhuǎn)化率(α)與體系總壓強(qiáng)(p)的關(guān)系如圖所示.下列說法正確的是( )
4.某溫度下,發(fā)生反應(yīng)N2(g)+3H2(g)?2NH3(g)ΔH=-92.4kJ?mol-1,N2的平衡轉(zhuǎn)化率(α)與體系總壓強(qiáng)(p)的關(guān)系如圖所示.下列說法正確的是( )A.將1molN2和3molH2置于1L密閉容器中發(fā)生反應(yīng),放出的熱量為92.4kJ B.平衡狀態(tài)由A到B時(shí),平衡常數(shù)K(A)<K(B) C.增大壓強(qiáng),H2的平衡轉(zhuǎn)化率增大 D.降低溫度,平衡常數(shù)K減小 組卷:23引用:5難度:0.5 -
5.已知25℃時(shí)有關(guān)弱酸的電離平衡常數(shù):則下列有關(guān)說法正確的是( )
弱酸化學(xué)式 CH3COOH HCN H2CO3 電離平衡常數(shù) 1.8×10-5 4.9×10-10 K1=4.3×10-7
K2=5.6×10-11A.等物質(zhì)的量濃度的各溶液pH關(guān)系為:pH(CH3COOH)>pH(H2CO3)>pH(HCN) B.醋酸溶液加水稀釋,其電離程度先增大后減小 C.NaCN中通入少量CO2發(fā)生的化學(xué)反應(yīng)為:NaCN+CO2+H2O═HCN+NaHCO3 D.稀釋HCN溶液過程中, 減小c(CN-)c(HCN)組卷:160引用:6難度:0.6 -
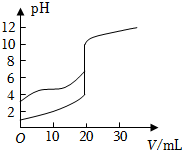 6.室溫下,用0.100mol?L-1NaOH溶液分別滴定20.00mL0.100mol?L-1的鹽酸和醋酸,滴定曲線如圖所示,下列說法不正確的是( )
6.室溫下,用0.100mol?L-1NaOH溶液分別滴定20.00mL0.100mol?L-1的鹽酸和醋酸,滴定曲線如圖所示,下列說法不正確的是( )A.Ⅱ表示的是滴定鹽酸的曲線 B.pH=7時(shí),滴定醋酸溶液消耗的V(NaOH)等于20.00mL C.滴定醋酸溶液過程中,當(dāng)消耗V(NaOH)等于10.00mL時(shí),此時(shí)溶液中 >1c(CH3COO-)c(CH3COOH)D.滴定醋酸溶液、鹽酸時(shí),均可選擇酚酞溶液作為指示劑 組卷:41引用:7難度:0.6
三、解答題(共5小題,滿分60分)
-
 19.某課外興趣小組欲測(cè)定某鹽酸溶液的濃度,其操作步驟如下:
19.某課外興趣小組欲測(cè)定某鹽酸溶液的濃度,其操作步驟如下:
①將酸式滴定管用蒸餾水洗凈,用待測(cè)溶液潤(rùn)洗后,再注入待測(cè)溶液,調(diào)節(jié)滴定管的尖嘴部分充滿溶液,并使液面處于“0”刻度以下的位置,記下讀數(shù);將錐形瓶用蒸餾水洗凈后,用待測(cè)溶液潤(rùn)洗錐形瓶2~3次;從酸式滴定管中放出25.00mL待測(cè)溶液到錐形瓶中。
②將堿式滴定管用蒸餾水洗凈后,立即向其中注入0.1000mol?L-1標(biāo)準(zhǔn)NaOH溶液,調(diào)節(jié)滴定管的尖嘴部分充滿溶液,并使液面處于“0”刻度以下的位置,記下讀數(shù)。
③向錐形瓶中滴入酚酞作指示劑,進(jìn)行滴定。滴定至終點(diǎn),測(cè)得所耗NaOH溶液的體積為V1mL。
④若按正確操作進(jìn)行三次實(shí)驗(yàn),其消耗的NaOH溶液的體積見表:
試回答下列問題:次數(shù) 1 2 3 體積(mL) 12.48 12.52 12.04
(1)達(dá)到滴定終點(diǎn)時(shí)的現(xiàn)象為;該鹽酸溶液的濃度為。
(2)該小組在步驟①中的錯(cuò)誤是,由此造成的測(cè)定結(jié)果。(填“偏高”或“偏低”或“無影響”)
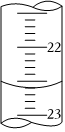
(3)如圖是某次滴定時(shí)的堿式滴定管中的液面,其讀數(shù)為mL。組卷:49引用:6難度:0.4 -
20.某小組利用H2C2O4溶液與用硫酸酸化的KMnO4溶液反應(yīng)來探究“條件對(duì)化學(xué)反應(yīng)速率的影響”.實(shí)驗(yàn)時(shí),先分別量取兩種溶液,然后倒入試管中迅速振蕩混合均勻并開始計(jì)時(shí).該小組設(shè)計(jì)了如下方案:
(1)該探究實(shí)驗(yàn)判斷反應(yīng)快慢的需測(cè)量的物理量是:編號(hào) H2C2O4溶液 酸性KMnO4溶液 蒸餾水體積/mL 溫度/℃ 濃度/mol?L-1 體積/mL 濃度/mol?L-1 體積/mL ① 0.50 6.0 0.010 4.0 0 25 ② 0.50 3.0 0.010 4.0 a 25 ③ 0.50 6.0 0.010 4.0 0 50 .
(2)實(shí)驗(yàn)①測(cè)得反應(yīng)所用的時(shí)間為20s,忽略混合前后溶液體積的微小變化,這段時(shí)間內(nèi)平均反應(yīng)速率v(KMnO4)=.
(3)已知H2C2O4被KMnO4(H+)氧化為CO2逸出,該反應(yīng)的離子方程式為,為了觀察到實(shí)驗(yàn)現(xiàn)象從而判斷反應(yīng)的快慢,H2C2O4與KMnO4初始的物質(zhì)的量需要滿足的關(guān)系為.
(4)探究溫度對(duì)化學(xué)反應(yīng)速率影響的實(shí)驗(yàn)編號(hào)是(填編號(hào));欲通過實(shí)驗(yàn)編號(hào)①②探究H2C2O4濃度對(duì)化學(xué)反應(yīng)速率影響,則a=.
(5)該小組通過分析室溫下反應(yīng)速率走勢(shì)(如圖),認(rèn)為t1~t2時(shí)間內(nèi)速率變快除反應(yīng)放熱溫度升高外還有其他原因,若想驗(yàn)證這一原因,除酸性高錳酸鉀溶液、草酸溶液試劑外,還需要選擇最合理的試劑是(填字母).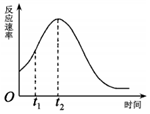
A.硫酸鉀
B.硫酸錳
C.稀硫酸
D.氯化錳組卷:17引用:6難度:0.6


