2021-2022學(xué)年浙江省杭州市桐廬中學(xué)高二(上)段考化學(xué)試卷(10月份)
發(fā)布:2024/4/20 14:35:0
一、選擇題(本大題共20小題,每小題3分共60分.每個(gè)小題列出的四個(gè)備選項(xiàng)中只有一個(gè)是符合題目要求的,不選、多選、錯(cuò)選均不得分)
-
1.下列說法中不正確的是( )
A.化學(xué)反應(yīng)一定伴隨著能量變化 B.加熱才能發(fā)生的化學(xué)反應(yīng)一定為吸熱反應(yīng) C.化學(xué)反應(yīng)能量變化不一定表現(xiàn)為熱能 D.放熱反應(yīng)還是吸熱反應(yīng),本質(zhì)上決定于反應(yīng)物的總能量和生成物總能量的相對(duì)大小 組卷:6引用:1難度:0.7 -
2.下列事實(shí)中,能用勒夏特列原理解釋的是( )
A.配制FeSO4溶液時(shí),加入一些鐵粉 B.500℃左右比室溫更有利于合成氨的反應(yīng) C.實(shí)驗(yàn)室常用排飽和食鹽水的方法收集氯氣 D.由H2、I2(g)、HI組成的平衡體系,加壓后顏色加深 組卷:185引用:10難度:0.7 -
3.氫氰酸(HCN)的下列性質(zhì)中,可以證明它是弱電解質(zhì)的是( )
A.HCN易溶于水 B.10mL1mol/LHCN恰好與10mL1mol/LNaOH溶液完全反應(yīng) C.1mol/L氫氰酸溶液的pH約為3 D.HCN溶液的導(dǎo)電性比鹽酸溶液的弱 組卷:11引用:2難度:0.7 -
4.下列說法正確的是( )
A.凡是放熱反應(yīng)都是自發(fā)的,因?yàn)槲鼰岱磻?yīng)都是非自發(fā)的 B.自發(fā)反應(yīng)的熵一定增大,非自發(fā)反應(yīng)的熵一定減小 C.常溫下,反應(yīng)C(s)+CO2(g)?2CO(g)不能自發(fā)進(jìn)行,則該反應(yīng)的△H>0 D.反應(yīng)2Mg(s)+CO2(g)═C(s)+2MgO(s)能自發(fā)進(jìn)行,則該反應(yīng)的△H>0 組卷:886引用:24難度:0.9 -
5.下列說法正確的是( )
A.活化分子的平均能量稱為活化能 B.活化分子互相碰撞即可發(fā)生化學(xué)反應(yīng) C.催化劑是通過增大反應(yīng)所需的活化能來增大反應(yīng)速率的 D.升高溫度會(huì)加快化學(xué)反應(yīng)速率,其原因是增加了活化分子的百分率 組卷:52引用:6難度:0.5 -
 6.pH=2的A、B兩種酸溶液各1mL,分別加水稀釋到1000mL,其pH與溶液體積V的關(guān)系如圖所示。下列說法正確的是( )
6.pH=2的A、B兩種酸溶液各1mL,分別加水稀釋到1000mL,其pH與溶液體積V的關(guān)系如圖所示。下列說法正確的是( )A.A、B兩酸溶液的物質(zhì)的量濃度一定相等 B.a(chǎn)=5時(shí),A是強(qiáng)酸,B是弱酸 C.稀釋后,A酸溶液的酸性比B酸溶液強(qiáng) D.若A、B都是弱酸,則5≥a>2 組卷:22引用:1難度:0.6 -
7.肼(H2N-NH2)是一種高能燃料,共價(jià)鍵的鍵能與熱化學(xué)方程式信息如表。則2N(g)═N2(g)的△H為( )
共價(jià)鍵 N-H N-N O=O O-H 鍵能/(kJ?mol-1) 391 161 498 463 熱化學(xué)方程式 N2H4(g)+O2(g)═N2(g)+2H2O (g)△H=-570kJ?mol-1 A.-941kJ?mol-1 B.941kJ?mol-1 C.-483kJ?mol-1 D.483kJ?mol-1 組卷:27引用:3難度:0.7 -
8.燃燒a g C2H5OH(l),生成二氧化碳?xì)怏w和液態(tài)水,放出的熱量為QkJ,經(jīng)測(cè)定,生成的CO2與足量澄清石灰水反應(yīng)得到100g沉淀,則表示乙醇燃燒的熱化學(xué)方程式是( )
A.C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-QkJ?mol-1 B.C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-2QkJ?mol-1 C. C2H5OH(l)+12O2(g)═CO2(g)+32H2O(g)△H=-QkJ?mol-132D.C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-2QkJ?mol-1 組卷:55引用:3難度:0.7
二、非選擇題(本大題共4小題,共40分)
-
23.硫酰氯(SO2Cl2)和亞硫酰氯(SOCl2)均是重要的化工試劑,遇水發(fā)生劇烈反應(yīng),常用作脫水劑。
已知:①SO2Cl2(g)?SO2(g)+Cl2(g)△H=+471.7kJ/mol K1
②SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H=-477.3kJ/mol K2
(1)反應(yīng)2SOCl2(g)?SO2Cl2(g)+SCl2(g)的平衡常數(shù)K=(用K1、K2表示),該反應(yīng)△H=kJ/mol。
(2)若在絕熱、恒容的密閉容器中,投入一定量的SO2Cl2(g)和SCl2(g),發(fā)生反應(yīng)SO2Cl2(g)+SCl2(g)?2SOCl2(g),如圖中能說明t1時(shí)刻反應(yīng)達(dá)到平衡狀態(tài)的是。(填字母)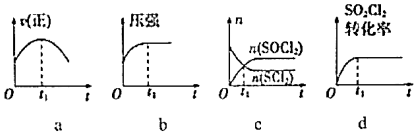
(3)在恒溫條件下,向2L恒容密閉容器中加入0.2mol SO2Cl2,10min后反應(yīng)①達(dá)到平衡。測(cè)得10min內(nèi)v(SO2)=8.0×10-3mol?L-1?min-1,則平衡時(shí)SO2Cl2的轉(zhuǎn)化率a1=。組卷:9引用:2難度:0.6 -
 24.霧霾天氣多次肆虐我國中東部地區(qū),京津地區(qū)一度誕生了“霧霾假期”。要有效控制霧霾改善大氣質(zhì)量,有效控制空氣中氮氧化物、碳氧化物和硫氧化物顯得尤為重要。其中,汽車尾氣和燃煤尾氣是造成空氣污染的原因之一。
24.霧霾天氣多次肆虐我國中東部地區(qū),京津地區(qū)一度誕生了“霧霾假期”。要有效控制霧霾改善大氣質(zhì)量,有效控制空氣中氮氧化物、碳氧化物和硫氧化物顯得尤為重要。其中,汽車尾氣和燃煤尾氣是造成空氣污染的原因之一。
(1)汽車尾氣凈化的主要原理為2NO(g)+2CO(g)?2CO2(g)+N2(g)。在密閉容器中發(fā)生該反應(yīng)時(shí),c(CO2)隨溫度(T)、催化劑的表面積(S)和時(shí)間(t)的變化曲線,如圖所示。據(jù)此判斷:
①該反應(yīng)的ΔH0(填“>”或“<”)。
②在T1溫度下,0~2s內(nèi)的平均反應(yīng)速率v(N2)=。
③當(dāng)固體催化劑的質(zhì)量一定時(shí),增大其表面積可提高化學(xué)反應(yīng)速率.若催化劑的表面積S1<S2,在圖中畫出c(CO2)在T1、S2條件下達(dá)到平衡過程中的變化曲線。
④若該反應(yīng)在絕熱、恒容的密閉體系中進(jìn)行,下列示意圖正確且能說明反應(yīng)在進(jìn)行到t1時(shí)刻達(dá)到平衡狀態(tài)的是(填字母)。
(2)一氧化碳是一種用途相當(dāng)廣泛的化工基礎(chǔ)原料。可以還原金屬氧化物,還可以用來合成很多有機(jī)物如甲醇等.在壓強(qiáng)為0.1MPa條件下,將amolCO與3amolH2的混合氣體在催化劑作用下反應(yīng)生成甲醇:CO+2H2(g)=CH3OHΔH=-bkJ?mol-1。
①若容器容積不變,下列措施可提高CO轉(zhuǎn)化率的是。
A.升高溫度
B.將CH3OH(g)從體系中分離
C.充入He,使體系總壓強(qiáng)增大
D.再充入1molCO和3molH2
②經(jīng)測(cè)定不同溫度下該反應(yīng)的平衡常數(shù)如下:
若某時(shí)刻,250℃測(cè)得該反應(yīng)的反應(yīng)物與生成物的濃度分別為c(CO)=0.4mol?L-1、c(H2)=0.4mol?L-1、c(CH3OH)=0.8mol?L-1,則此時(shí)v正溫度(℃) 250 300 350 K 2.041 0.270 0.012 v逆(填“>”、“<”或“=”)。
③汽車燃油不完全燃燒時(shí)產(chǎn)生CO,有人設(shè)想按下列反應(yīng)除去CO:2CO(g)=2C(s)+O2(g),已知該反應(yīng)的ΔH>0,判斷該設(shè)想能否實(shí)現(xiàn),并簡(jiǎn)述原因:。組卷:12引用:1難度:0.6


