2020-2021學年陜西省西安鐵一中高二(下)期中化學試卷
發布:2024/12/19 22:0:1
一、選擇題(本大題共25小題,每小題2分,共50分)
-
1.在物質結構研究的歷史上,首先提出原子內有原子核的科學家是( )
A.湯姆生 B.道爾頓 C.盧瑟福 D.玻爾 組卷:4引用:1難度:0.7 -
2.下列說法正確的是( )
A.基態原子的能量一定比激發態原子的能量低 B.1s22s12p1表示的是基態原子的電子排布 C.日常生活中我們看到的許多可見光,如霓虹燈光、節日焰火,都與原子核外電子發生躍遷釋放能量有關 D.電子由3d能級躍遷至4p能級時,可通過光譜儀直接攝取到原子的發射光譜 組卷:4引用:1難度:0.6 -
3.下列表達方式或說法正確的是( )
A.某原子核外電子排布式為ns2np7,它違背了洪特規則 B.氯化銨的電子式: 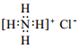
C.NH3、H2O、CO2、HCl四分子中孤電子對最多的是CO2 D.硫離子的核外電子排布式1s22s22p63s23p4 組卷:5引用:1難度:0.6 -
4.下列化學用語的表達正確的是( )
A.Mn2+的外圍電子排布式:3d5 B.氯原子的結構示意圖: 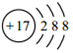
C.氧原子核外有2種不同運動狀態的電子 D.基態銅原子的價層電子排布圖:  組卷:7引用:1難度:0.7
組卷:7引用:1難度:0.7 -
5.四種元素基態原子的電子排布式如下:①1s22s22p63s23p1;②1s22s22p63s2;③1s22s2;④1s22s22p1.則有關比較中正確的是( )
A.第一電離能:④>③>②>① B.原子半徑:④>③>①>② C.最高正化合價:④=①>③=② D.電負性:③>④>①>② 組卷:132引用:3難度:0.5 -
6.在“石蠟→液體石蠟→石蠟蒸氣→裂化氣”的變化過程中,被破壞的主要作用力依次是( )
A.范德華力、范德華力、氫鍵 B.范德華力、范德華力、共價鍵 C.共價鍵、共價鍵、共價鍵 D.范德華力、氫鍵、共價鍵 組卷:23引用:4難度:0.7 -
7.下列敘述正確的是( )
A. 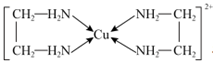 該配合物中配體是H2NCH2CH2NH2,配位數是2
該配合物中配體是H2NCH2CH2NH2,配位數是2B. 離子的空間構型為V形,中心原子的雜化形式為sp3I+3C. 、CN-等與N2互為等電子體,則O2-2和CN-的結構式分別為O≡O2-、C≡N-O2-2D.HNO3分子的中心原子的價層電子對數為4,該分子的VSEPR模型是正四面體形 組卷:11引用:1難度:0.6 -
8.圖甲和圖乙表示的是元素的某種性質隨原子序數的變化。下列說法正確的是( )

A.圖乙不可能表示元素的電負性隨原子序數的變化關系 B.圖甲可能表示的是元素單質的熔點隨原子序數的變化關系 C.圖乙可能表示的是元素原子的半徑隨原子序數的變化關系 D.圖甲可能表示的是元素原子的第一電離能隨原子序數的變化關系 組卷:36引用:4難度:0.5 -
9.按電子排布,可把周期表里的元素劃分成5個區,區的名稱來自按構造原理最后填入電子的能級符號,5個區分別為s區、d區、p區、ds區和f區.電子構型為[Xe]4f145d76s2的元素位于周期表中的哪個區( )
A.s區 B.d區 C.f區 D.ds區 組卷:25引用:4難度:0.7
二、非選擇題(本大題共4小題,共50分)
-
 28.近幾個月,古城西安的大街上新添了很多橙黃色的汽車。這款被稱作“小黃蜂”的出租車是由清潔的甲醇燃料驅動的。使用甲醇燃料可以有效的減少汽車尾氣的排放,對西安市治污減霾工作有重要的意義。工業上常用CO和H2合成甲醇,反應方程式為CO(g)+2H2(g)?CH3HO(g)ΔH。
28.近幾個月,古城西安的大街上新添了很多橙黃色的汽車。這款被稱作“小黃蜂”的出租車是由清潔的甲醇燃料驅動的。使用甲醇燃料可以有效的減少汽車尾氣的排放,對西安市治污減霾工作有重要的意義。工業上常用CO和H2合成甲醇,反應方程式為CO(g)+2H2(g)?CH3HO(g)ΔH。
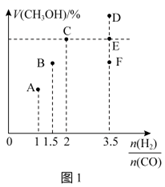
Ⅰ.(1)在T1時,體積為2L的恒容容器中充入物質的量之和為3mol的H2和CO,達到平衡時CH3OH的體積分數V(CH3OH)%與n(H2):n(CO)的關系如圖1所示。
①當起始n(H2):n(CO)=2,經過5min達到平衡,此時容器的壓強是初始壓強的0.7倍,則0~5min內平均反應速率v(H2)=。若此時再向容器中加入0.15molCO(g)和0.05molCH3OH(g),達新平衡時H2的轉化率將(填“增大”“減小”或“不變”)。
②當起始n(H2):n(CO)=3.5時,達到平衡狀態后,CH3OH的體積分數可能是圖象中的點(填“D”“E”或“F”)。
Ⅱ.(2)若CO的轉化率與壓強、溫度的關系可由圖2表示。
①由圖2可知該反應的ΔH0(填“>”“<”或“=”,下同),壓強p1p2;當壓強為p2時,在y點:v正v逆。
②以甲醇為燃料、強堿溶液作電解質溶液的新型手機電池,充滿電后可連續使用一個月,試寫出放電時,負極的電極反應為:。組卷:4引用:1難度:0.5 -
29.錫及其化合物在生產、生活中有著重要的用途。已知:Sn的熔點為231℃;Sn2+易水解、易被氧化;SnCl4極易水解、熔點為-33℃、沸點為114℃。請按要求回答下列相關問題:
(1)用于鍍錫工業的硫酸亞錫(SnSO4)的制備步驟如下:
Ⅰ.SnCl2加入鹽酸和Sn粉;
Ⅱ.分離濾渣和濾液;
Ⅲ.濾液用NaHCO3調節pH至6~7得混合物(含不溶物SnO);
Ⅳ.從混合物中分離得SnO;
Ⅴ.SnO和稀硫酸反應,經一系列操作后,最終得SnSO4晶體。
①步驟Ⅰ加入Sn粉的作用:及調節溶液pH。
②步驟Ⅲ生成SnO的離子方程式:。
③步驟Ⅳ中檢驗SnO是否洗滌干凈的操作是,證明已洗凈。
④步驟Ⅴ操作依次為、、過濾、洗滌、低溫干燥。
(2)SnCl4蒸氣遇氨及水汽呈濃煙狀,因而可制作煙幕彈,其反應的化學方程式為。實驗室欲用如圖裝置制備少量SnCl4(夾持裝置略),該裝置存在明顯缺陷,改進方法是。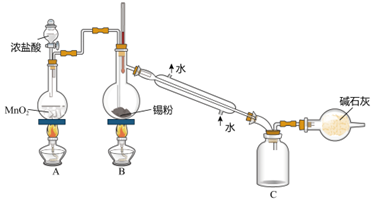
(3)利用改進后的裝置進行實驗,當開始裝置C中收集到有SnCl4時即可熄滅B處酒精燈,反應仍可持續進行的理由是。
(4)用于微電子器件生產的錫粉純度測定:
①取1.19g試樣溶于較濃硫酸中(雜質不參與反應),使Sn完全轉化為Sn2+;
②加入過量的Fe2(SO4)3;
③用0.1000mol/L K2Cr2O7溶液滴定,消耗20.00mL。
步驟②中加入Fe2(SO4)3的作用是:;此錫粉樣品中錫的質量分數:。組卷:3引用:1難度:0.6


