2022-2023學年浙江省杭州地區(含周邊)重點中學高二(下)期中化學試卷
發布:2024/4/26 11:36:51
一、選擇題(本題包括16小題,每小題3分,共48分。每小題只有一個選項符合題意。)
-
1.下列鹽類能抑制水的電離的是( )
A.NaCl B.NaHCO3 C.NaOH D.NaHSO4 組卷:58引用:1難度:0.7 -
2.氮的氧化物眾多,下列說法不正確的是( )
A.N元素價層電子排布式為:2s22p3 B.NO是一種無色的氣體,有舒張軟化血管的作用 C.2NO2?N2O4是吸熱反應 D.N2O5是硝酸的酸酐,溶于水后顯酸性 組卷:12引用:1難度:0.5 -
3.下列化學用語正確的是( )
A.羥基的電子式: 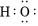
B.H2SO3的電離方程式:H2SO3?2H++ SO2-3C.聯氨N2H4的結構式為: 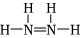
D.TNT的結構簡式: 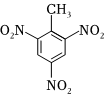 組卷:11引用:1難度:0.5
組卷:11引用:1難度:0.5 -
4.化學在工農業生產和日常生活中都有重要應用,下列敘述正確的是( )
A.華為自主研發的“麒麟”芯片與太陽能電池感光板所用主要材料為晶體硅 B.二氧化硫有毒,嚴禁將其添加到任何食品和飲料中 C.自來水廠常用明礬、O3、ClO2等做水處理劑,其作用都是殺菌消毒 D.用于制造“山東艦”上艦載機降落攔阻索的特種鋼,屬于新型無機非金屬材料 組卷:17引用:1難度:0.6 -
5.下列說法正確的是( )
A. N2與147N2互為同位素157B.異丁烷和2-甲基丙烷互為同分異構體 C.乙醇和二甲醚互為同分異構體,可用金屬鈉鑒別 D. 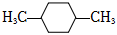 的一氯代物只有2種(不考慮立體異構)組卷:35引用:1難度:0.8
的一氯代物只有2種(不考慮立體異構)組卷:35引用:1難度:0.8 -
6.關于反應Ⅰ:6NaOH+3S=2Na2S+Na2SO3+3H2O和反應Ⅱ:6HNO3+S=H2SO4+6NO2+2H2O,下列說法正確的是( )
A.Na2S和NO2均為還原產物 B.反應I中還原劑與氧化劑的物質的量之比為2:1 C.兩反應中S都只發生了氧化反應 D.兩反應中消耗64gS時,轉移電子數目相同 組卷:33引用:1難度:0.7 -
7.下列離子方程式書寫正確的是( )
A.用FeS除去廢水中的Hg2+:FeS+Hg2+=HgS+Fe2+ B.NaHSO4溶液與Ba(OH)2溶液混合至呈中性:Ba2++OH-+ +H+=BaSO4↓+H2OSO2-4C.向Na2S溶液中滴加NaClO溶液:S2-+ClO-+2H+=S↓+Cl-+H2O D.家用84漂白液(NaClO)的漂白原理:2ClO-+H2O+CO2=2HClO+ CO2-3組卷:29引用:1難度:0.5
二、填空題(本大題共5小題,共52分)
-
20.檸檬酸C6H8O7是一種三元有機酸,易溶于水,受熱易分解,廣泛存在于檸檬等桔類水果中,(NH4)3Fe(C6H5O7)2(檸檬酸鐵銨)用于醫學、食品業等,易溶于水(20℃時溶解度120),不溶于乙醇、乙醚等有機溶劑,可用作食品鐵強化劑。實驗室由硫酸亞鐵和檸檬酸等為原料制備檸檬酸鐵銨產品的主要實驗流程如圖:
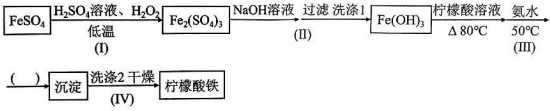
(1)寫出步驟Ⅰ的離子方程式為。
(2)步驟ⅡFe(OH)3洗滌的操作方法為。
(3)步驟Ⅲ控制溫度80℃的目的是。
(4)請為上述制備流程選擇更合理的操作或試劑:
①步驟Ⅰ中FeSO4與H2O2的混合方式。
a.FeSO4溶液逐滴加入H2O2中
b.H2O2逐滴加入FeSO4溶液中
②步驟Ⅲ中的合理的操作。
a.低溫濃縮至有大量晶體析出,停止加熱
b.低溫濃縮至表面有晶膜出現,停止加熱,冷卻結晶
(5)為測定某補血劑樣品[主要成分是硫酸亞鐵晶體(FeSO4?7HO)中鐵元素的含量,某化學興趣小組設計了如下實驗方案,取10片補血劑,加入一定量稀硫酸溶解后,配成250mL溶液,取25.00mL溶液于錐形瓶中,用0.00500mol?L-1酸性KMnO4溶液滴定,重復實驗平均消耗酸性KMnO4溶液10.00mL。已知滴定過程反應的離子方程式為:+5Fe2++8H+=Mn2++5Fe3++4H2O,若實驗無損耗,則每片補血劑Fe的含量為MnO-4mg。組卷:18引用:2難度:0.5 -
21.化學反應原理中的相關理論可用于指導實驗及工業生產中的各項問題,請回答下列問題:
(1)工業上,常采用以高鈦渣(主要成分為TiO2)為原料進行“加碳氯化”的方法生產TiCl4,相應的化學方程式為:
Ⅰ.TiO2(s)+2Cl2(g)?TiCl4(g)+O2(g) ΔH1=+181kJ?mol-1 K1=3.4×10-29
Ⅱ.2C(s)+O2(g)?2CO(g)ΔH2=-221kJ?mol-1 K2=1.2×1048
①下列措施能提高Cl2的平衡轉化率的是。
A.保持恒容通入惰性氣體
B.在反應器中增加C和TiO2的含量
C.提高反應溫度
D.增大容器體積以減小體系壓強
②結合數據,說明氯化過程中加碳的理由。
(2)T℃下H2S可直接分解制取H2,反應的原理如下:2H2S(g)?2H2(g)+S2(g)。實際生產中往剛性容器中同時通入H2S和水蒸氣,水蒸氣與反應體系的任何物質均不發生反應,測得容器總壓(P總壓)和H2S的轉化率(a)隨時間的變化關系如圖1所示,計算反應在0-20min內的平均反應速率v(H2)=kPa?min-1;平衡時,平衡常數Kp=kPa(Kp為以分壓表示的平衡常數)。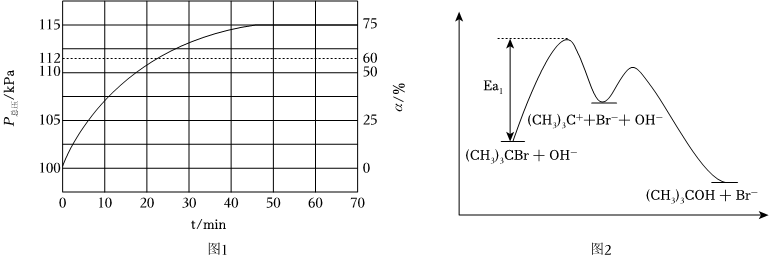
(3)已知(CH3)3CBr+OH-=(CH3)3COH+Br-的反應歷程分兩步:
①(CH3)3CBr=(CH3)3C++Br-
②(CH3)3C++OH-=(CH3)3COH
反應進程中的勢能圖如圖2所示:如果增加(CH3)3CBr濃度,反應速率將(填:加快、不變或變慢),如果增加OH濃度反應速率(填:加快、不變或變慢),并結合反應勢能圖解釋。組卷:79引用:3難度:0.5


