2021-2022學年廣東省廣州市番禺區高一(上)期末化學試卷
發布:2024/11/24 9:30:6
一、選擇題(本題包括16小題,1-10題每小題2分,11-16題每小題2分,共44分)注意:每道選擇題有四個選項,其中只有一個選項符合題意。請用鉛筆在答題卡上作答。錯選、不選、多選或涂改不清的,均不給分。
-
1.我國“蛟龍”號載人潛水器已成功下潛至海中7062.68米處。“蛟龍”號載人潛水器的外殼是耐超高壓的鈦合金,下列有關合金的說法不正確的是( )
A.鈦合金是一種新型合金 B.鈦合金的硬度比金屬鈦低 C.青銅、合金鋼和硬鋁都是合金 D.儲氫合金可用于以H2為燃料的汽車 組卷:18引用:1難度:0.6 -
2.能用H++OH-=H2O來表示的化學反應是( )
A.Fe(OH)3溶液和HNO3溶液反應 B.NaHCO3溶液和NaOH溶液反應 C.KOH溶液和NaHSO4溶液反應 D.KOH溶液和CH3COOH溶液反應 組卷:29引用:2難度:0.6 -
3.下列物質不屬于電解質的是( )
A.導電的石墨 B.氣態的HCl C.可溶的KNO3 D.弱堿性的NH3?H2O 組卷:33引用:1難度:0.8 -
4.考古時利用14C測定文物的年代,下列關于14C的說法正確的是( )
A.核外電子數為8 B.質子數與中子數之差為8 C.與14N互為同位素 D.能與O2反應生成14CO2 組卷:129引用:3難度:0.8 -
5.在無色的強酸性溶液中,下列各組離子能大量共存的是( )
A.Al3+、SO42-、NH4+ B.Cu2+、NO3-、SO42- C.Fe3+、OH-、SCN- D.K+、HCO3-、NO3- 組卷:10引用:1難度:0.7 -
6.設NA為阿伏加德羅常數們,下列有關敘述正確的是( )
A.32gO2含有的氧原子數為NA B.常溫常壓下,18g水所含電子數目為10NA C.1mol/LNa2SO4溶液中離子總數為6NA D.在標準狀況下,1molO2和H2混合氣體所占的體積為44.8L 組卷:50引用:3難度:0.6
二、非選擇題(包括4小題,共56分)
-
19.某同學在實驗室對鈉的化合物相關樣品進行定性、定量研究:
(1)實驗1:某純堿樣品只含NaCl雜質,現測定樣品中Na2CO3的含量。稱取樣品ag,采用如圖1實驗裝置進行實驗:
①寫出Y形管中稀硫酸與樣品發生反應的離子方程式:。
②試劑X最佳選擇是(填標號)。
A.飽和Na2CO3溶液
B.飽和NaHCO3溶液
C.飽和NaCl溶液
③讀數時,若水準管的液面高于量氣管的液面,則樣品中Na2CO3的含量(填“偏高”、“偏低”或“不影響”)。
④實驗結束時,所測得氣體體積為VmL。設實驗時的氣體摩爾體積為VmL/mol,則樣品中Na2CO3的質量分數為。
(2)實驗Ⅱ:碳酸鈉和碳酸氫鈉穩定性探究。
①如圖2實驗中試劑A和試劑B分別是、。
②試管中受熱處發生反應的化學方程式:。
(3)實驗Ⅲ:若加熱NaHCO3和Na2O2的混合物,剩余固體成分會因二者物質的量不同而發生變化。當n(NaHCO3):n(Na2O2)=4:3混合后,加熱使其充分反應,試管內剩余固體為Na2CO3和NaOH,兩者物質的量之比是。組卷:21引用:2難度:0.5 -
20.某工廠以鎳廢渣(主要成分為Ni,含少量Fe、Fe3O4、Al2O3和不溶性雜質等)為原料制備翠礬(NiSO4?7H2O),其生產工藝如圖:
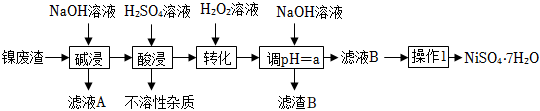
該流程中幾種金屬離子生成對應氫氧化物沉淀的pH如表:
回答下列問題:金屬離子 開始沉淀的pH 完全沉淀的pH Fe3+ 2.7 3.7 Fe2+ 7.6 9.7 Ni2+ 7.1 9.2
(1)“濾液A”中主要溶質的化學式為。
(2)“轉化”過程中加入H2O2的目的是將“酸浸”后溶液中的Fe2+氧化為Fe3+,該過程用離子方程式表示為;“轉化”過程中溫度不宜過高,原因是。
(3)調節pH=a,是為了將溶液中的元素完全沉淀,則a的取值范圍是。證明雜質離子已經被完全除去的實驗操作及現象是:取少量濾液B于試管中,。
(4)“操作1”的具體操作是控制pH、蒸發濃縮、冷卻結晶、、洗滌、干燥。
(5)硫酸鎳在強堿溶液中用NaClO氧化,可沉淀出能用作鎳鎘電池正極材料的NiOOH。寫出該反應的離子方程式。組卷:21引用:1難度:0.6


