2021-2022學年安徽省六安一中高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每小題3分,共48分,每小題僅有一個最佳答案)
-
1.下列關于能量變化的說法正確的是( )
A.“冰,水為之,而寒于水”說明相同質量的水和冰相比較,冰的能量高 B.化學反應在物質變化的同時,伴隨著能量變化,其表現形式只有吸熱和放熱兩種 C.1molH2的能量大于2molH的能量 D.化學反應遵循質量守恒的同時,也遵循能量守恒 組卷:6引用:3難度:0.5 -
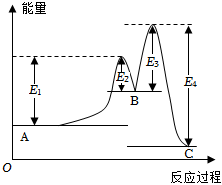 2.某反應由兩步反應A→B→C構成,它的反應能量曲線如圖所示(E1、E2、E3、E4表示活化能).下列有關敘述正確的是( )
2.某反應由兩步反應A→B→C構成,它的反應能量曲線如圖所示(E1、E2、E3、E4表示活化能).下列有關敘述正確的是( )A.兩步反應均為吸熱反應 B.加入催化劑會改變反應的焓變 C.三種化合物中C最穩定 D.A→C反應中△H=E1-E2 組卷:106引用:14難度:0.9 -
3.已知兩個熱化學方程式:
①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol,
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
現有0.2mol 炭粉和氫氣組成的懸浮氣,在氧氣中完全燃燒,共放出67.93kJ的熱量,則混合物中C和H2的物質的量之比為( )A.1:1 B.1:2 C.2:3 D.3:2 組卷:40引用:15難度:0.7 -
4.某溫度下,反應2A(g)?B(g)-Q(Q>0)在密閉容器中達到平衡,平衡后
=a,若改變某一條件,足夠時間后反應再次達到平衡狀態,此時c(A)c(B)=b,下列敘述正確的是( )c(A)c(B)A.若其他條件不變,升高溫度,則a<b B.若保持溫度、壓強不變,充入惰性氣體,則a>b C.若保持溫度、容積不變,充入少量B氣體,則a<b D.若保持溫度、壓強不變,充入B氣體,則a=b 組卷:24引用:2難度:0.5 -
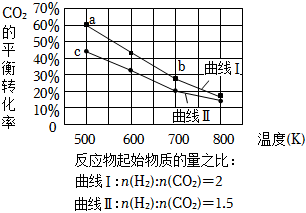 5.一定條件下,6H2(g)+2CO2(g)?C2H5OH(g)+3H2O(g),CO2平衡轉化率隨溫度變化如圖所示,對a、b、c 三點對應情況的分析,合理的是( )
5.一定條件下,6H2(g)+2CO2(g)?C2H5OH(g)+3H2O(g),CO2平衡轉化率隨溫度變化如圖所示,對a、b、c 三點對應情況的分析,合理的是( )A.CO2物質的量分數:a>b B.C2H5OH體積分數:a>c C.平衡常數:Ka>kc>kb D.反應速率:va(CO2)>vb(CO2) 組卷:52引用:2難度:0.5 -
6.煙氣中的氮氧化物可以用低溫脫硝技術處理,保障尾氣脫硝后達標排放,已知在恒容密閉容器中發生以下化學反應:2NH3(g)+NO(g)+NO2(g)
2N2(g)+3H2O(g)ΔH<0,下列說法正確的是( )催化劑△A.若其他條件不變,使用催化劑會增大廢氣中氮氧化物的平衡轉化率 B.若其他條件不變,升高溫度可以減小該反應的平衡常數 C.若其他條件不變,向容器中鼓入NH3會減小廢氣中氮氧化物的轉化率 D.若其他條件不變,及時將氮氣排出可以增大該反應的平衡常數 組卷:8引用:2難度:0.5
二、填空題(共52分)
-
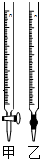 19.(1)某學生用0.1500mol/L NaOH溶液測定某未知濃度的鹽酸溶液,其操作可分解為如下幾步:
19.(1)某學生用0.1500mol/L NaOH溶液測定某未知濃度的鹽酸溶液,其操作可分解為如下幾步:
A.用蒸餾水洗凈滴定管
B.用待測定的溶液潤洗酸式滴定管
C.用酸式滴定管取稀鹽酸25.00mL,注入錐形瓶中,加入酚酞
D.另取錐形瓶,再重復操作2~3次
E.檢查滴定管是否漏水
F.取下堿式滴定管用標準NaOH溶液潤洗后,將標準液注入堿式滴定管“0”刻度以上2~3cm處,再把堿式滴定管固定好,調節液面至“0”刻度或“0”刻度以下
G.把錐形瓶放在滴定管下面,瓶下墊一張白紙,邊滴邊搖動錐形瓶直至滴定終點,記下滴定管液面所在刻度
完成以下填空:
(1)滴定時正確操作的順序是(用序號字母填寫):→→F→→→→D。
(2)操作F中應該選擇圖中滴定管(填標號)。
(3)滴定時邊滴邊搖動錐形瓶,眼睛應注意觀察。
(4)滴定結果如表所示:
計算該鹽酸的物質的量濃度為滴定次數 待測液體積/mL 標準溶液的體積/mL 滴定前刻度 滴定后刻度 1 25.00 1.02 21.03 2 25.00 0.60 20.60 3 25.00 0.20 20.19 (精確至0.0001)。
(5)下列操作會導致測定結果偏高的是。
A.堿式滴定管在裝液前未用標準NaOH溶液潤洗
B.滴定過程中,錐形瓶搖蕩得太劇烈,錐形瓶內有液滴濺出
C.堿式滴定管尖嘴部分在滴定前沒有氣泡,滴定終點時發現氣泡
D.達到滴定終點時,仰視讀數
(6)、氧化還原滴定實驗與酸堿中和滴定類似(用已知濃度的氧化劑溶液滴定未知濃度的還原劑溶液或反之)。測血鈣的含量時,進行如下實驗:
①可將2mL血液用蒸餾水稀釋后,向其中加入足量草酸銨(NH4)2C2O4晶體,反應生成 CaC2O4沉淀,將沉淀用稀硫酸處理得H2C2O4溶液。
②將①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化產物為CO2,還原產物為Mn2+。
③終點時用去20mL 1.0×l0-4 mol/L的KMnO4溶液。
Ⅰ、寫出用KMnO4滴定H2C2O4的離子方程式。
Ⅱ、判斷滴定終點的方法是。
Ⅲ、計算:血液中含鈣離子的濃度為mol/L。組卷:182引用:7難度:0.4 -
20.已知25℃時,幾種常見弱酸的Ka。如表所示:
(1)25℃時,pH值相同的下列幾種溶液:①Na2C2O4②CH3COONa③NaCN④Na2CO3,其物質的量濃度由大到小的順序是電解質 H2C2O4 CH3COOH HCN H2CO3 電離常數 K1=5.6×10-2K2=5.4×10-3 K=1.7×10-5 K=6.2×10-10 K1=4.2×10-7K2=5.6×10-11 。(用序號填空)
(2)KHC2O4溶液呈酸性,向10mL0.01mol/L的H2C2O4溶液滴加0.01mol/LKOH溶液V(mL)。回答下列問題:
①當V<10mL時,反應的離子方程式為。
②當V=10mL時,溶液中HC2O4-、C2O42-、H2C2O4、H+的濃度由大到小的順序為。
③當V=amL時,溶液中離子濃度有如下關系:c(K+)=2c(C2O42-)+c(HC2O4-);當V=bmL時,溶液中離子濃度有如下關系:c(K+)═c(C2O42-)+c(HC2O4-)+c(H2C2O4);則ab(填“<”“=”或“>”)。
(3)寫出向NaCN溶液中通入少量CO2氣體發生反應的離子方程式:。組卷:13引用:1難度:0.6


