2021-2022學年河北省唐山市灤南一中高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、單選題(共9小題,每小題3分,共27分)
-
1.下列關于化學反應中熱量變化的說法,正確的是( )
A.吸熱反應都不能自發進行 B.放熱反應的生成物鍵能之和大于反應物鍵能之和 C.甲烷作為燃料其熱值比氫的熱值高 D.把煤制成水煤氣(CO和H2),會提高燃燒放出的熱量 組卷:0引用:1難度:0.7 -
2.用CH4催化還原NOx,可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574kJ?mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160kJ?mol-1
下列說法不正確的是( )A.用標準狀況下4.48L CH4還原NO2生成N2和水蒸氣,放出的熱量為173.4kJ B.由反應①可推知:CH4(g)+4NO2(g)=4NO+CO2(g)+2H2O(l)ΔH<-574kJ?mol-1 C.若均有1mol甲烷反應時,反應①②轉移的電子數相同 D.反應①和②都消除了氮氧化物的污染 組卷:6引用:1難度:0.6 -
3.下列離子反應方程式中能正確表達水解反應的是( )
A.HCO3-+H2O?H3O++CO32- B.S2-+2H2O?H2S+2OH- C.ClO-+H2O?HClO+OH- D.Al3++3H2O=Al(OH)3+3H+ 組卷:1引用:1難度:0.6 -
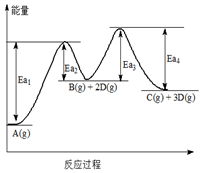 4.已知A轉化為C和D分兩步進行:①A(g)?B(g)+2D(g);②B(g)?C(g)+D(g),其反應過程能量變化如圖所示,下列說法正確的是( )
4.已知A轉化為C和D分兩步進行:①A(g)?B(g)+2D(g);②B(g)?C(g)+D(g),其反應過程能量變化如圖所示,下列說法正確的是( )A.1molA(g)的能量低于1molB(g)的能量 B.B(g)?C(g)+D(g)△H=Ea4-Ea3 C.由圖可知,Ea3<Ea1,故反應②速率大于反應① D.反應①②都是吸熱反應 組卷:5引用:1難度:0.6 -
5.已知4NH3+5O2═4NO+6H2O,反應速率分別用v(NH3)、v(O2)、v(NO)、v(H2O)表示,正確的是( )
A. v(O2)═v(NO)45B. v(O2)═v(H2O)56C. v(NH3)═v(H2O)23D. v(NH3)═v(O2)45組卷:0引用:1難度:0.7
三、非選擇題。
-
16.在25℃時,三種酸的電離平衡常數如表:
(1)寫出H2CO3的電離平衡常數Ka1的表達式化學式 CH3COOH H2CO3 H2SO3 電離平衡常數 Ka=1.8×10-5 Ka1=4.4×10-7
Ka2=4.4×10-11Ka1=1.5×10-2
Ka2=1.02×10-7。
(2)常溫下將1mLpH均為3的醋酸和亞硫酸都稀釋100倍,pH較大的是。
(3)CH3COONa水溶液中含有的離子有(寫離子符號)。
(4)常溫下,無水醋酸加水稀釋過程溶液的導電能力隨加水的體積V的變化曲線如圖所示,則a、b、c三點醋酸的電離度最大的是。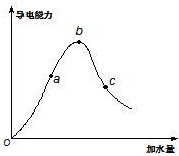
(5)如果用0.1mol?L-1的NaOH溶液滴定20mL未知濃度的醋酸,選用酚酞作指示劑,達滴定終點的顏色變化是。下列相關操作會造成所測定醋酸的濃度偏高的有。
A.用未知液洗錐形瓶
B.量取未知液的酸式滴定管只用水洗
C.滴定結束時,讀取堿液體積時俯視刻度
D.配制NaOH標準液時,所用NaOH固體中含有KOH組卷:3引用:1難度:0.7 -
17.目前,世界各國相繼規劃了碳達峰、碳中和。開發CO2利用技術、降低空氣中CO2含量成為研究熱點。可采用以下方法將CO2進行資源化利用。
(1)CO2催化加氫制甲醇
一定溫度下,在某恒容密閉容器中充入一定量的CO2和H2,發生反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)。下列敘述能說明反應已達到平衡狀態的是(填標號)。
A.混合氣體的密度不再隨時間變化
B.氣體的壓強不再隨時間變化
C.CH3OH的物質的量分數不再隨時間變化
D.單位時間內每形成3molH-H鍵,同時形成3molC-H鍵
(2)CO2催化加氫合成乙烯
在10L某恒容密閉容器中,充入1.4molCO2和4.2molH2,發生反應:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)ΔH。反應達到平衡后,四種組分的物質的量分數x隨溫度T的變化如圖所示。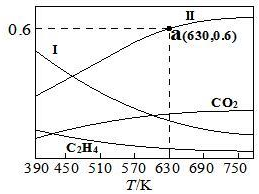
①該反應的ΔH0(填“>”或“<”),曲線Ⅰ和曲線Ⅱ分別表示(填化學式,下同)和的變化曲線。
②根據圖中a點,計算該溫度下平衡時的n(H2O)=mol,c(C2H4)=mol?L-1,CO2的轉化率為%(保留三位有效數字)。
③若平衡時a點容器內氣體的總壓強為0.25MPa,則該反應平衡常數Kp=(MPa)-3(列出計算式即可,分壓=總壓×物質的量分數,Kp就是用分壓代替平衡濃度求算的平衡常數)
(3)CO2用途廣泛,寫出其基于物理性質的一種用途:。組卷:23引用:1難度:0.3


