2020-2021學年湖北省襄陽市襄州二中高一(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題:本題共16小題,每小題3分,共48分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.下列物質的用途錯誤的是( )
A.Al2O3:耐火材料 B.Na2O2:供氧劑 C.晶體硅:光導纖維 D.硅膠:干燥劑 組卷:9引用:1難度:0.5 -
2.下列試劑貯存方法錯誤的是( )
A.過氧化鈉密封保存 B.氫氟酸保存在玻璃瓶中 C.金屬鈉保存在煤油中 D.燒堿溶液保存在帶橡皮塞的玻璃瓶中 組卷:0引用:1難度:0.8 -
3.下列有關金屬的說法正確的是( )
A.Na久置于空氣中最終生成NaOH B.Mg比Al活潑,更易于NaOH溶液反應生成H2 C.水蒸氣通過灼熱的鐵粉有紅棕色固體生成 D.某些合金比其成分金屬熔點低,硬度大 組卷:6引用:1難度:0.5 -
4.下列實驗現象或表述正確的是( )
A.在酒精燈火焰上灼燒鋁箔,會發現熔化的鋁不斷滴落 B.某無色溶液滴加酚酞試液顯紅色,試溶液的溶質不一定是堿 C.向飽和FeCl3溶液中滴入少量NaOH溶液,煮沸后即得紅褐色Fe(OH)3膠體 D.Fe(OH)2在空氣中加熱,得到黑色的FeO固體 組卷:7引用:1難度:0.7 -
5.與標準狀況下V L CO2所含有氧原子數目相同的水的質量是( )
A. 44V22.4gB. V22.4gC. 36V22.4gD. 18V22.4g組卷:85引用:7難度:0.9 -
6.NA表示阿伏加德羅常數的值,下列說法正確的是( )
A.1molCl2(g)與過量Fe(s)在加熱條件下反應,轉移電子的數目為2NA B.0.1mol/L的氯化鋁溶液中,含有氯數目為0.3NA C.71g氯氣溶于水得到的氯水中含有氯化氫分子數目為NA D.常溫常壓下,11.2LCO含有原子數目為NA 組卷:6引用:1難度:0.8
二、非選擇題:本題共4小題,共52分。
-
19.蛇紋石礦可以看作由MgO(40%)、Fe2O3(8%)、Al2O3(12%)、SiO2(40%)組成,由蛇紋石制取堿式碳酸鎂的實驗步驟如圖:
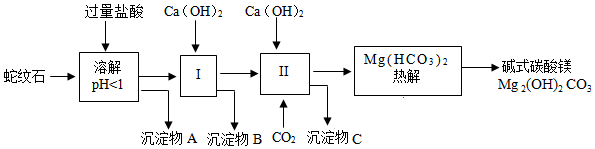
(1)蛇紋石礦加鹽酸溶解后,溶液里除了Mg2+外,還含有的金屬離子是。
(2)沉淀物A的化學式為。
(3)生成堿式碳酸鎂的化學方程式為。
(4)進行I操作時,控制溶液的pH=7~8,其目的是將鐵、鋁元素轉化為氫氧化物進入沉淀物B中,Ca(OH)2不能過量,若Ca(OH)2過量可能會導致溶解(填物質化學式)。
(5)完成從沉淀物B中提取紅棕色氧化物顏料的流程如下:沉淀物B□濾渣()洗滌□紅棕色氧化物顏料。【“□”內填所加試劑化學式,“( )”填實驗操作名稱】()
①□:;
②( ):、。
(6)取100g蛇紋石進行上述實驗,最終制得堿式碳酸鎂56.8g,則產率為。【已知:產率=(實際產量+理論產量)×100%】組卷:6引用:1難度:0.5 -
20.鐵氧體是一類磁性材料,通式為MO?xFe2O3(M為二價金屬離子),如FeO?Fe2O3(即Fe3O4)。可利用化學共沉淀法制備Fe3O4,步驟如下:
i.將一定濃度的FeCl3和FeCl2溶液按照一定的比例混合后放入燒瓶中;
ii.溫度控制在30℃,在氮氣的氛圍下,緩慢滴加0.4mol/L的NaOH溶液至pH=9;
iii.80℃水浴恒溫30min;
iv.過濾,洗滌,干燥。
按照要求回答以下問題:
(1)步驟i中配制FeCl2溶液時需加入少量鐵屑,其目的是。
(2)檢驗FeCl2溶液是否變質的方法是。
(3)理論上,步驟i中原料FeCl3和FeCl2的物質的量之比應為。
(4)配制250mL0.4mol/L的NaOH溶液,用托盤天平稱取NaOH固體的質量為;定容時,若仰視則所配溶液的濃度(填“偏大”、“偏小”或“不受影響”)。
(5)步驟iv中,判斷產品是否洗滌干凈的方法是。
(6)在一次制備Fe3O4的實驗中,由于反應物比例控制不當,獲得了另一種產品。取a克該產品溶于100mL鹽酸(足量)中,需要通入672mL(標準狀況)Cl2才能把溶液中的Fe2+全部氧化為Fe3+,然后蒸干所得溶液,灼燒至恒重,得9.6gFe2O3。請回答以下問題
①通入Cl2發生反應的離子方程式為;
②該產品溶于鹽酸后,溶液中Fe2+的物質的量濃度;
③該產品的化學式為。組卷:4引用:1難度:0.6


