2021-2022學(xué)年山東省泰安市新泰一中(東校)高三(上)期中化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(本題包括10小題,每小題2分,共20分。每小題只有一個(gè)選項(xiàng)符合題意)
-
1.我國(guó)大力弘揚(yáng)中華優(yōu)秀傳統(tǒng)文化體現(xiàn)“文化自信”。下列有關(guān)說(shuō)法錯(cuò)誤的是( )
A.制備“白玉金邊素瓷胎,雕龍描鳳巧安排”中的瓷,主要原料為黏土 B.商代后期鑄造出了工藝精湛的司母戊鼎,該鼎屬于銅合金制品 C.成語(yǔ)“百煉成鋼”、“沙里淘金”中均包含了化學(xué)變化 D.《本草綱目》中有關(guān)于釀酒的記載“凡酸壞之酒,皆可蒸燒”,其描述的過(guò)程是蒸餾 組卷:47引用:5難度:0.7 -
2.下列有關(guān)物質(zhì)性質(zhì)與用途說(shuō)法對(duì)應(yīng)正確的是( )
A.膠體的膠粒帶電荷,利用這一性質(zhì)可進(jìn)行“血液透析”和“靜電除塵” B.CaO能與SO2反應(yīng),可作工業(yè)廢氣脫硫劑 C.NaHCO3 能與堿反應(yīng),因此食品工業(yè)上可用作焙制糕點(diǎn)的膨松劑 D.液氨分解要吸熱,工業(yè)上可用作制冷劑 組卷:10引用:1難度:0.8 -
3.設(shè)NA為阿伏加德羅常數(shù)值。下列有關(guān)敘述正確的是( )
A.2g D2O中含有的質(zhì)子數(shù)、中子數(shù)、電子數(shù)均為NA B.將100mL 0.1mol?L-1FeCl3溶液滴入沸水中可制得Fe(OH)3膠粒數(shù)為0.01NA C.1mol NaOH晶體中,含有的離子總數(shù)為3NA D.100mL 0.1mol?L-1 的氨水中,含NH3?H2O的數(shù)目為0.01NA 組卷:16引用:2難度:0.8 -
4.不能正確表示下列反應(yīng)的離子方程式是( )
A.Fe2O3溶于過(guò)量氫碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O B.0.1mol/L NH4Al(SO4)2溶液與0.2mol/LBa(OH)2溶液等體積混合:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+[(AlOH)4]- C.用稀硫酸酸化的KMnO4溶液與H2O2反應(yīng),證明H2O2具有還原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O D.向FeBr2溶液(含溶質(zhì)amol)中通入amol氯氣:2Fe2++2Br-+2Cl2=2Fe3++Br2+ 4Cl- 組卷:8引用:2難度:0.6 -
5.下列有關(guān)實(shí)驗(yàn)裝置(尾氣處理裝置已省略)進(jìn)行的相應(yīng)實(shí)驗(yàn),不能達(dá)到實(shí)驗(yàn)?zāi)康牡氖牵ā 。?br />
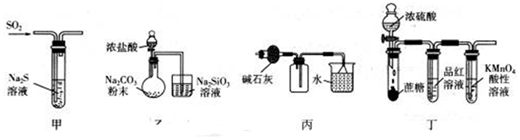
A.利用甲裝置,驗(yàn)證SO2或H2SO3具有氧化性 B.利用乙裝置,驗(yàn)證元素的非金屬性:Cl>C>Si C.利用丙裝置,進(jìn)行NH3的干燥、收集、尾氣處理 D.利用丁裝置,驗(yàn)證濃H2SO4具有脫水性、強(qiáng)氧化性,SO2具有漂白性、還原性 組卷:55引用:5難度:0.5 -
6.用下列實(shí)驗(yàn)裝置進(jìn)行相應(yīng)的實(shí)驗(yàn),能達(dá)到實(shí)驗(yàn)?zāi)康牡氖牵ā 。?/h2>
A. 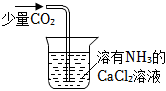
用裝置制CaCO3B. 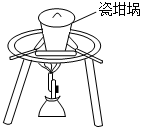
用裝置熔融Na2CO3C. 
用裝置制取乙酸乙酯D. 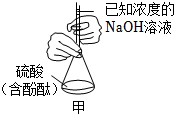
用裝置滴定未知濃度的硫酸組卷:12引用:3難度:0.5
三、非選擇題共60分)
-
19.某化學(xué)興趣小組的同學(xué)利用下圖所示實(shí)驗(yàn)裝置進(jìn)行NH 3的制備、性質(zhì)等實(shí)驗(yàn)。
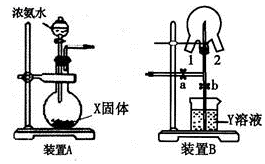
(1)裝置A中的燒瓶?jī)?nèi)的X固體宜選用(填序號(hào))。
a.消石灰 b.氯化鈣 c.五氧化二磷 d.生石灰燒瓶中制取NH 3的化學(xué)方程式為。
(2)為制取干燥的氨氣,可將裝置A與下列裝置(填序號(hào))進(jìn)行連接。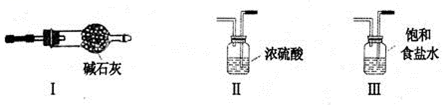
(3)裝置B可用于探究氯氣與氨氣的反應(yīng)。實(shí)驗(yàn)時(shí)先通過(guò)三頸瓶瓶口1通入氨氣,然后關(guān)閉b活塞,再通過(guò)瓶口通入氯氣。
①實(shí)驗(yàn)中三頸瓶?jī)?nèi)出現(xiàn)白煙并在內(nèi)壁凝結(jié)成固體,發(fā)生反應(yīng)的化學(xué)方程式為,請(qǐng)?jiān)O(shè)計(jì)一個(gè)實(shí)驗(yàn)方案鑒定該固體中的陽(yáng)離子;
②實(shí)驗(yàn)完畢后,觀察到三頸瓶?jī)?nèi)還有黃綠色氣體,簡(jiǎn)述如何處理才能不污染環(huán)境。組卷:51引用:2難度:0.6 -
20.為探索某工廠的廢金屬屑(主要成分為Fe、Cu、Al、Al2O3、Fe2O3等)的再利用,某化學(xué)興趣小組設(shè)計(jì)了如圖實(shí)驗(yàn)流程,用該工廠的合金廢料制取氯化鋁、膽礬晶體(CuSO4?5H2O)和水處理劑高鐵酸鉀(K2FeO4)。
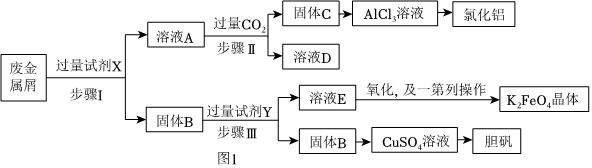
請(qǐng)回答:
(1)試劑X是;試劑Y是。
(2)從CuSO4溶液中獲取膽礬晶體的操作是過(guò)濾、洗滌。
(3)寫(xiě)出溶液A轉(zhuǎn)化為固體C的離子方程式。
(4)由溶液E制取K2FeO4時(shí),不同的溫度下,不同質(zhì)量濃度的Fe3+對(duì)K2FeO4生成率有不同影響,由圖2可知工業(yè)生產(chǎn)中最佳條件(溫度和Fe3+的質(zhì)量濃度g?L-1)為。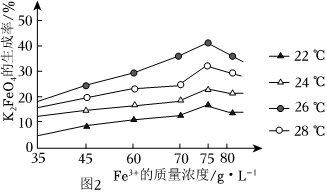
(5)在固體F中加入稀硫酸和H2O2來(lái)制備CuSO4溶液是一種環(huán)保工藝,該反應(yīng)的總的離子方程式為。
(6)該小組同學(xué)取用100.0g該廢金屬屑,經(jīng)過(guò)實(shí)驗(yàn),最終得到膽礬晶體25.0g,該廢料中銅的質(zhì)量分?jǐn)?shù)約為。組卷:13引用:2難度:0.6


