2021-2022學年黑龍江省牡丹江三中高二(上)期中化學試卷(理科)
發布:2024/4/20 14:35:0
一、選擇題(本題包括25小題,每小題2分,共50分。每小題只有一個選項符合題意)。
-
1.下列反應中,屬于吸熱反應同時又是氧化還原反應的是( )
A.灼熱的炭與水蒸氣生成水煤氣的反應 B.鋁與稀鹽酸 C.鋁熱反應 D.Ba(OH)2?8H2O與NH4Cl反應 組卷:24引用:1難度:0.8 -
2.在密閉容器里,A與B反應生成C,其反應速率分別用vA、vB、vC表示,已知2vB=3vA、3vC=2vB,則此反應可表示為( )
A.2A+3B=2C B.A+3B=2C C.3A+B=2C D.A+B=C 組卷:1095引用:127難度:0.9 -
3.下列事實不能用平衡移動原理解釋的是( )
A.由H2(g)、I2(g)、HI(g)組成的平衡體系通過縮小體積加壓后顏色變深 B.重鉻酸鉀溶液中存在:Cr2O72-(橙色)+H2O?2CrO42-(黃色)+2H+,若滴加少量NaOH溶液,溶液由橙色變黃色 C.實驗室用排飽和食鹽水的方法收集Cl2 D.將盛有NO2和N2O4混合氣體的密閉容器置于冰水中,混合氣體的顏色變淺 組卷:13引用:2難度:0.5 -
4.反應Ⅰ:H2(g)+I2(g)?2HI(g)的平衡常數為K1;反應Ⅱ:HI(g)?
H2(g)+12I2(g)的平衡常數為K2,上述反應的平衡常數為同溫度下的測定值,則K1、K2的關系為( )12A.K1=K2 B.K1= K212C.K1= K213D.K1= 1K22組卷:76引用:2難度:0.8 -
5.已知反應X+Y=M+N為吸熱反應,對這個反應的下列說法正確的是( )
A.X的能量一定低于M的能量,Y的能量一定低于N的能量 B.X和Y的總能量一定低于M和N的總能量 C.破壞反應物中的化學鍵所吸收的能量小于形成生成物中化學鍵所放出的能量 D.因為該反應為吸熱反應,故反應一定要加熱才能進行 組卷:50引用:9難度:0.9 -
6.在下列敘述中,不能說明醋酸是弱電解質的是( )
A.室溫下,CH3COOH溶液中氫離子濃度小于相同濃度的鹽酸溶液中氫離子濃度 B.室溫下,0.1mol?L-1的CH3COOH溶液的pH=3 C.醋酸中加水后,溶液的pH升高 D.0.1mol?L-1的CH3COOH導電能力不如0.1mol?L-1的鹽酸強 組卷:16引用:1難度:0.5 -
7.下列物質的水溶液呈酸性的是( )
A.NaCl B.NaHCO3 C.CH3COONa D.NaHSO4 組卷:24引用:1難度:0.5 -
8.下列說法或表示方法中正確的是( )
A.同溫同壓下,H2(g)+Cl2(g)═2HCl(g)在光照和點燃條件下的△H相同 B.使用催化劑能降低反應的活化能,所以也能改變反應的焓變 C.甲烷的燃燒熱為-890.3kJ/mol,則其熱化學方程式為:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ/mol D.稀的強酸和稀的強堿溶液反應的熱化學方程式均為:H++OH-═H2O△H=-57.3kJ?mol-1 組卷:12引用:5難度:0.9 -
9.下列說法正確的一組是( )
①不溶于水的鹽都是弱電解質
②可溶于水的鹽都是強電解質
③0.5mol?L-1一元酸溶液中H+濃度為0.5mol?L-1
④強酸溶液中的H+濃度不一定大于弱酸溶液中的H+濃度
⑤電解質溶液導電的原因是溶液中有自由移動的陰陽離子
⑥熔融的電解質都能導電A.①③⑤⑥ B.只有④⑤ C.②④⑤⑥ D.只有③⑥ 組卷:197引用:6難度:0.8 -
10.25℃時,水的電離達到平衡:H2O?H++OH-;△H>0,下列敘述正確的是( )
A.向水中加入稀氨水,平衡逆向移動,c(OH-)降低 B.將水加熱,KW增大,pH不變 C.向水中加入少量固體CH3COONa,平衡逆向移動,c(H+)降低 D.向水中加入少量固體硫酸氫鈉,c(H+)增大,KW不變 組卷:95引用:10難度:0.9
二、填空題
-
29.合成氨工業在國民生產中有重要意義,以下是關于氮與氫氣合成氨的有關問題,請回答:
(1)平衡后,若提高H2的轉化率,可以采取的措施有。
A.加了催化劑
B.增大容器體積
C.降低反應體系的溫度
D.加入一定量N2
(2)若在0.5L的密閉容器中,一定量的氮氣和氫氣進行如下反應:N2(g)+3H2(g)?2NH3(g)ΔH<0,其化學平衡常數K與溫度T的關系如表所示:
請完成下列問題:T/℃ 200 300 400 K K1 K2 0.5
①試比較K1、K2的大小,K1K2(填“<”“>”或“=”);
②400℃時,反應2NH3(g)?N2(g)+3H2(g)的化學平衡常數為。當測得NH3、N2和H2物質的量分別為3mol、2mol和1mol時,則該反應的v(N2)正v(N2)逆(填“<”“>”或“=”)。
(3)根據化學反應速率和化學平衡理論,聯系合成氨的生產實際,你認為下列說法不正確的是。
A.化學反應速率理論可指導怎樣在一定時間內快出產品
B.勒夏特列原理可指導怎樣使用有限原料多出產品
C.催化劑的使用是提高產品產率的有效方法
D.正確利用化學反應速率和化學反應限度理論都可以提高化工生產的綜合經濟效益組卷:5引用:1難度:0.7 -
30.水溶液中的離子離子反應與平衡。
(1)在一定溫度下,有
a.鹽酸
b.硫酸
c.醋酸三種酸:
a.當三種酸物質的量濃度相同時,c(H+)由大到小的順序是(用字母表示,下同)。
b.同體積、同物質的量濃度的三種酸,中和NaOH 的能力由大到小的順序是。
c.若三者c(H+)相同時,物質的量濃度由大到小的順序是。
(2)已知常溫下,NH3?H2O的電離常數為Kb=1.8×10-5,若氨水的濃度為2.0mol?L-1,則溶液中OH-的濃度是mol?L-1。
(3)在200 mL氫氧化鋇溶液中含有1×10-3 mol的鋇離子,溶液的pH值為。
將此溶液與pH=3的鹽酸混合,使其混合溶液的pH=7,應取氫氧化鋇溶液和鹽酸的體積之比是。
(4)室溫下,使用pH計測定0.1mol/LNH4Cl溶液的pH=5.12(如圖),由此可以得到的結論是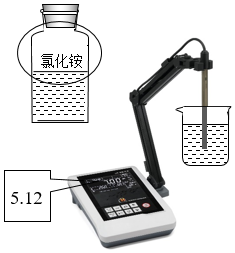
a.NH3?H2O是弱堿
b.溶液中c(H+)>c(OH-)
c.NH4+水解是吸熱反應
d.由H2O電離出的c(H+)<10-7mol/L
e.物質的量濃度相等的氨水和鹽酸等體積混合,溶液pH=7
試用方程式解釋0.1mol/LNH4Cl溶液呈酸性的原因。組卷:4引用:1難度:0.5


