2018-2019學年北京市通州區高三(上)期中化學試卷
發布:2024/4/20 14:35:0
一、本題包括14小題,每小題只有一個選項符合題意(每小題3分,共42分)
-
1.以下是中華民族為人類文明進步做出巨大貢獻的幾個事例,運用化學知識對其進行的分析不合理的是( )
A.商代后期鑄造出工藝精湛的后(司)戊鼎,該鼎屬于銅合金制品 B.四千余年前用谷物釀造出酒和醋,釀造過程中只發生水解反應 C.漢代燒制出“明如鏡、聲如磬”的瓷器,其主要原料為黏土 D.屠呦呦用乙醚從青蒿中提取出對治療瘧疾有特效的青蒿素,該過程包括萃取操作 組卷:3引用:1難度:0.7 -
2.化學科學需要借助化學專用語言描述,下列有關化學用語正確的是( )
A.中子數為18的硫原子: S3416B.鐵紅的化學式為Fe3O4 C.甲醛的結構簡式:CH2O D.CO2的電子式: 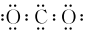 組卷:10引用:1難度:0.3
組卷:10引用:1難度:0.3 -
3.化學已經滲透到人類生活的各個方面,下列說法不正確的是( )
A.衛生間與鐵器接觸的瓷磚上的斑斑銹跡,可用稀鹽酸清洗 B.治療紅眼病可用95%的酒精沖洗眼睛進行殺菌消毒 C.“地溝油”禁止食用,但可以經過加工處理制肥皂或生物柴油,可以實現廚余廢物利用 D.停車場安裝催化光解設施,可將汽車尾氣中的CO和NO反應生成無毒氣體 組卷:0引用:1難度:0.7 -
4.油條的做法是將礬、堿、鹽按比例加入溫水中,再加入面粉攪拌成面團;放置,使面團產生氣體,形成孔洞。放置過程發生反應:2KAl(SO4)2?12H2O+3Na2CO3═2Al(OH)3↓+3Na2SO4+K2SO4+3CO2↑+21H2O。下列判斷正確的是( )
A.從物質的分類角度來看,油條配方中的“礬、堿、鹽”主要成分均為鹽 B.放置過程發生的反應為氧化還原反應 C.放置過程發生的反應中,反應物和生成物均為電解質 D.反應的離子方程式為2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ 組卷:30引用:5難度:0.7 -
5.一定條件下,某容器中各微粒在反應前后變化的示意圖如下,其中“●”和“〇”分別代表不同元素的原子.關于此反應說法不正確的是( )

A.可能是雙氧水分解反應 B.充分反應后,還有  物質,則屬于可逆反應
物質,則屬于可逆反應C.反應前后,一定是共價鍵的斷裂與生成 D.該反應可表示為:  =
= +
+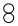 組卷:46引用:3難度:0.5
組卷:46引用:3難度:0.5 -
6.下列解釋事實的離子方程式正確的是( )
A.明礬做凈水劑:Al3++3H2O═Al (OH)3↓+3H+ B.小蘇打治療胃酸過多:CO32-+2H+═CO2↑+H2O C.漂白液加白醋,提高漂白效率:CH3COOH+ClO-═HClO+CH3COO- D.酸化的淀粉碘化鉀溶液在空氣中放置一段時間變藍:4I-+O2+2H2O═2I2+4OH- 組卷:19引用:3難度:0.7
二、第Ⅱ卷(非選擇題共58分)
-
19.有關元素X、Y、Z、W、R的性質或結構信息如下:
請用化學用語回答下列問題:元素 X Y Z W R 性質或結構信息 單質常溫常壓下是氣體,能形成+7價的化合物 人體中必需微量元素中含量最多,體內缺失Y會引起貧血 原子半徑為0.102nm,其原子核外電子排布為: 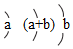
W的一種原子核內沒有中子 R元素是地殼中含量最多的元素
(1)Z在元素周期表中的位置是;X-的離子結構示意圖是。
(2)寫出X、W、R按原子個數之比1:1:1形成的化合物的電子式:。
(3)W與R可分別形成10電子和18電子的分子,寫出該18電子分子轉化成10電子分子的化學方程式:。
(4)X與Z相比,非金屬性較強的是(填元素符號),下列事實能證明這一結論的是(填字母)。
a.X元素氫化物的穩定性大于Z元素氫化物的穩定性
b.X元素氫化物水溶液的酸性強于Z元素氫化物水溶液的酸性
c.X元素的單質能與Z元素的氫化物反應,置換出Z單質
d.X的最高價含氧酸比Z的最高價含氧酸的酸性強
(5)Y元素和R元素可形成離子YR42-,含該離子的鹽是優良的綠色消毒劑和無機絮凝劑。
①YR42-具有強氧化性,能殺菌消毒,還原產物是Y3+;
②含該離子的鹽用作絮凝劑的原因是(用離子方程式和簡要的文字說明)。
(6)由Z、W、R三種元素組成的一種陰離子A,已知:①A既能與鹽酸反應,又能與氫氧化鈉溶液反應,還能和氯氣反應,寫出A與氯氣反應的離子方程式:;
②A的鈉鹽水溶液顯酸性,請解釋原因(用離子方程式和簡要的文字說明)。組卷:5引用:1難度:0.6 -
20.世界環保聯盟建議全面禁止使用氯氣用于飲用水的消毒,而建議采用高效“綠色”消毒劑二氧化氯。二氧化氯是一種極易爆炸的強氧化性氣體,易溶于水、不穩定、呈黃綠色,在生產和使用時必須盡量用稀有氣體進行稀釋,同時需要避免光照、震動或加熱。實驗室以電解法制備ClO2的流程如下:
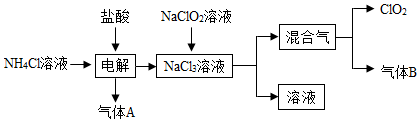
已知:①NCl3是黃色黏稠狀液體或斜方形晶體,極易爆炸,有類似氯氣的刺激性氣味,自然爆炸點為95℃,在熱水中易分解,在空氣中易揮發,不穩定。
②氣體B能使濕潤的紅色石蕊試紙變藍。
請回答下列問題:
(1)B的電子式。
(2)為保證實驗的安全,在電解時需注意的問題是:①控制好生成NCl3的濃度;②。
(3)NCl3:與NaClO2(亞氯酸鈉)按物質的量之比為1:6混合,在溶液中恰好反應生成ClO2,該反應的離子方程式為。
(4)工業上通過惰性電極電解氯化銨和鹽酸的方法制備ClO2,原理如下: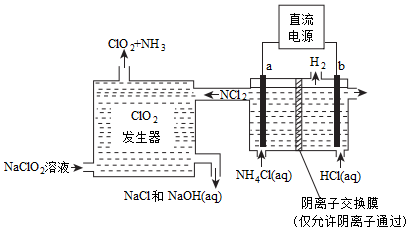
電解池中兩個電極的產物分別是NCl3和H2,寫出電解池總反應的離子方程式:。
(5)ClO2很不穩定,需隨用隨制,產物用水吸收得到ClO2溶液。為測定所得溶液中ClO2的含量,進行了下列實驗:
步驟1:準確量取ClO2溶液10mL,稀釋成100mL試樣;
步驟2:量取V1mL試樣加入到錐形瓶中,調節試樣的pH≤2.0,加入足量的KI晶體,搖勻,在暗處靜置30min;
步驟3:以淀粉溶液作指示劑,用cmol/L Na2S2O3溶液滴定至終點,消耗Na2S2O3溶液V2mL。(已知I2+2S2O32-═2I-+S4O62-)
①上述步驟3中滴定終點的現象是;
②根據上述步驟可計算出原ClO2溶液的濃度為mol/L(用含字母的代數式表示)。組卷:5引用:1難度:0.4


