2022-2023學年北京二中高二(上)月考化學試卷(11月份)
發布:2024/9/14 10:0:8
一.選擇題(每小題只有一個正確答案,每小題2分,共50分)
-
1.下列物質屬于弱電解質的是( )
A.CO2 B.H2O C.HNO3 D.NaOH 組卷:177引用:8難度:0.6 -
2.下列反應中,屬于吸熱反應的是( )
A.Al與鹽酸反應 B.鹽酸和NaOH溶液反應 C.乙醇燃燒反應 D.Ba(OH)2?8H2O晶體與NH4Cl固體反應 組卷:38引用:3難度:0.9 -
3.下列因素不可能影響化學平衡移動的是( )
A.溫度 B.催化劑 C.反應物的濃度 D.壓強 組卷:17引用:6難度:0.6 -
4.某原電池總反應為:Cu+2Fe3+═Cu2++2Fe2+,下列能實現該反應的原電池是( )
A B C D 電極材料 Cu、Zn Cu、Ag Cu、C Fe、Zn 電解液 FeCl3 Fe2(SO4)3 Fe(NO3)2 CuSO4 A.A B.B C.C D.D 組卷:173引用:18難度:0.9 -
5.下列物質的溶液在蒸發皿中加熱蒸干并灼燒,可以得到該物質的是( )
A.FeSO4 B.MgSO4 C.AlCl3 D.NH4Cl 組卷:64引用:6難度:0.9 -
6.在以下各種情形下,方程式的書寫正確的是( )
A.熔融狀態下的NaHSO4電離:NaHSO4═Na++H++SO42- B.H2CO3的電離:H2CO3?2H++CO32- C.NaHCO3的水解:HCO3-+H2O?H2CO3+OH- D.向硫酸鋁溶液中滴加碳酸鈉溶液:2Al3++3CO32-═Al2(CO3)3↓ 組卷:39引用:2難度:0.7 -
7.化學與生產、生活密切相關,下列事實與鹽類水解無關的是( )
A.藍礬可用于飲用水的殺菌消毒 B.熱純堿能除去物品表面的油污 C.明礬用于凈水 D.將FeCl3飽和溶液滴入沸水中制取Fe(OH)3膠體 組卷:84引用:2難度:0.7 -
8.在氨水中,存在著電離平衡:NH3?H2O?NH4++OH-。下列說法正確的是( )
A.溫度不變時,加水稀釋,電離平衡常數Kb增大 B.加入NaOH溶液,平衡一定向逆反應方向移動 C.加入NH4Cl固體,平衡向逆反應方向移動,c(NH4+)減小 D.加入冰醋酸,平衡向正反應方向移動 組卷:30引用:3難度:0.5 -
9.下列說法中,可以證明醋酸是弱電解質的是( )
A.醋酸溶液連接到一電路中,發現燈泡較暗 B.某溫度下,等濃度的醋酸溶液和鹽酸,醋酸溶液中水電離出的H+濃度較大 C.100mL0.1mol?L-1的醋酸溶液恰好中和10mL1mol?L-1的NaOH溶液 D.某溫度下,等濃度的醋酸鈉溶液和氫氧化鈉溶液中,氫氧化鈉溶液的pH較大 組卷:4引用:1難度:0.6
二.非選擇題(共50分;請將答案填寫在答題紙上)
-
28.某工廠利用制革工業污泥[含Cr(Ⅲ)]制取CrOH(H2O)5SO4的工藝流程如圖1所示:
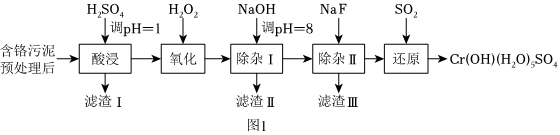
已知:酸浸取液中的金屬離子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+等。
(1)酸浸時,為了提高浸取率可采取的措施有。
(2)H2O2的作用是將濾液中的Cr3+轉化為Cr2,控制其他條件不變,在相同時間內,測得溫度對Cr3+轉化率的影響如圖2所示。請分析溫度超過70℃時,Cr3+轉化率下降的原因是O2-7。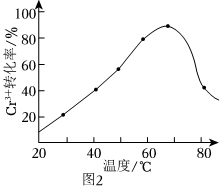
(3)常溫下,部分陽離子以氫氧化物形式沉淀時溶液的pH如下:
①濾渣Ⅱ的主要成分為陽離子 Fe3+ Al3+ Mg2+ Ca2+ 開始沉淀時的pH 1.5 3.4 8.9 11.9 沉淀完全時的pH 2.8 4.7(>8溶解) 10.9 14 (填化學式)。
②用NaOH調節溶液的pH不能超過8,其理由是。
(4)在“除雜Ⅱ”中,當溶液中鎂離子和鈣離子沉淀完全時,所得溶液中=c(Ca2+)c(Mg2+)。(已知:Ksp(CaF2)=1.48×10-10,Ksp(MgF2)=7.40×10-11)
(5)上述流程中,加入NaOH溶液后,溶液呈堿性,Cr2轉化為O2-7,寫出上述流程中的“還原”過程生成CrOH(H2O)5SO4沉淀的離子方程式CrO2-4。組卷:0引用:2難度:0.7 -
29.某小組探究Na2SO3溶液和KIO3溶液的反應。
實驗Ⅰ:向某濃度的KIO3酸性溶液(過量)中加入Na2SO3溶液(含淀粉),一段時間(t秒)后,溶液突然變藍。(資料:在酸性溶液氧化I-,反應為IO-3+5I-+6H+═3I2+3H2O)IO-3
(1)溶液變藍,說明Na2SO3具有性。
(2)針對t秒前溶液未變藍,小組做出如下假設:
ⅰ.t秒前未生成I2,是由于反應的活化能(填“大”或“小”),反應速率慢導致的。
ⅱ.t秒前生成了I2,但由于存在Na2SO3,(用離子方程式表示),I2被消耗。
(3)下述實驗證實了假設ⅱ合理。
實驗Ⅱ:向實驗Ⅰ的藍色溶液中加入,藍色迅速消失,后再次變藍。
(4)進一步研究Na2SO3溶液和KIO3溶液反應的過程,裝置如圖。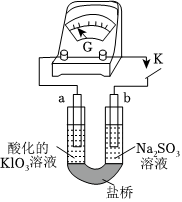
實驗Ⅲ:K閉合后,電流表的指針偏轉情況記錄如下表:
①K閉合后,取b極區溶液加入鹽酸酸化的BaCl2溶液,生成白色沉淀,則b極上的電極反應為表盤 
時間/min 0~t1 t2~t3 t4 偏轉位置 右偏至Y 指針回到“0”處,又返至“X”處;如此周期性往復多次?????? 指針歸零 。
②0~t1時,從a極區取溶液于試管中,滴加淀粉溶液,溶液變藍;直接向a極區滴加淀粉溶液,溶液未變藍。判斷在a極放電的產物是IO-3。
③結合反應解釋t2~t3時指針回到“0”處的原因:。
(5)綜合實驗Ⅰ、Ⅱ、Ⅲ,下列說法正確的是。
A.對比實驗Ⅰ、Ⅱ,t秒后溶液變藍,Ⅰ中被完全氧化SO2-3
B.對比實驗Ⅰ、Ⅲ,t秒前未發生反應IO-3
C.實驗Ⅲ中指針返回X處的原因,可能是I2氧化SO2-3組卷:4引用:2難度:0.6


