2022-2023學年福建省福州市屏東中學高一(下)期中化學試卷
發布:2025/1/2 16:0:3
一、選擇題(本大題有20小題,每小題2分,共40分。每小題只一個符合題意)
-
1.下列說法錯誤的是( )
A.三星堆青銅器屬于銅合金制品 B.諺語“雷雨發莊稼”,其過程包含氧化還原反應 C.成語“百煉成鋼”、“蠟炬成灰”均包含化學變化 D.詩句“折戟沉沙鐵未銷”中的金屬常溫下能溶于濃硝酸 組卷:9引用:2難度:0.8 -
2.下列物質之間的轉化,不能由化合反應一步完成的是( )
A.S→SO2 B.N2→NO2 C.FeCl2→FeCl3 D.Fe→FeCl3 組卷:31引用:3難度:0.5 -
3.目前電動車、手機等使用的新型電池——鋰電池,是一種高效、環保電池。已知鋰的金屬性介于鈉和鎂之間,則下列能冶煉出金屬鋰的方法是( )
A.電解法 B.高溫還原法 C.熱分解法 D.鋁熱還原法 組卷:70引用:2難度:0.7 -
4.下列各組離子一定能大量共存的是( )
A.H+、Fe2+、Cl-、 NO-3B.K+、Mg2+、 、SO2-4MnO-4C.Na+、Ca2+、Cl-、 CO2-3D.Na+、 、NH+4、OH-HCO-3組卷:22引用:4難度:0.6 -
5.物質氧化性、還原性的強弱,不僅與物質的結構有關,還與物質的濃度和反應溫度有關。下列各組物質:①Cu與HNO3溶液 ②Cu與FeCl3溶液 ③Zn與H2SO4溶液 ④Fe與HCl溶液。由于濃度不同而能發生不同氧化還原反應的是( )
A.①③ B.③④ C.①② D.①③④ 組卷:286引用:92難度:0.5 -
6.下列實驗操作能達到相應目的的是( )
選項 實驗目的 實驗內容 A 制備氫氧化鐵膠體 向沸騰的氫氧化鈉溶液中逐滴加入飽和氯化鐵溶液 B 檢驗溶液中是否含 NH+4取少量溶液,向其中加入濃NaOH溶液,加熱,在試管口放置濕潤的藍色石蕊試紙,觀察試紙是否變紅 C 證明二氧化硫具有漂白性 將二氧化硫氣體通入含有酚酞的氫氧化鈉溶液中,觀察溶液顏色變化 D 檢驗溶液中是否含Fe3+ 向溶液中加入幾滴KSCN溶液,觀察溶液是否變紅色 A.A B.B C.C D.D 組卷:12引用:4難度:0.6 -
7.如圖裝置用于氨的有關實驗時,能達到實驗目的的是( )
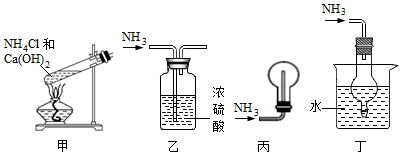
A.用裝置甲制備氨氣 B.用裝置乙干燥氨氣 C.用裝置丙收集氨氣 D.用裝置丁吸收多余的氨氣 組卷:81引用:9難度:0.5 -
8.用鐵片與稀硫酸反應制取氫氣時,下列措施不能使氫氣生成速率加快的是( )
①加熱 ②不用稀硫酸,改用98%的濃硫酸
③增加同濃度稀硫酸的用量 ④不用鐵片,改用鐵粉
⑤滴加幾滴CuSO4溶液。A.①②③④⑤ B.①③⑤ C.②③ D.③④ 組卷:28引用:2難度:0.6
二、解答題(共5小題,滿分60分)
-
 24.如圖是某同學設計的一個簡易的原電池裝置,請回答下列問題。
24.如圖是某同學設計的一個簡易的原電池裝置,請回答下列問題。
(1)若a電極材料為碳、b溶液為FeCl3溶液,則正極的電極反應式為,當有1.6g負極材料溶解時,轉移的電子為mol。
(2)若a電極材料為鐵、b溶液為稀硫酸,電流表的指針也會偏轉,則電子的流向為→(填電極材料,下同),溶液中的向SO2-4極移動。
(3)氫氧燃料電池已應用于航天飛機。“這種電池以30% KOH溶液為電解質溶液,供電時總反應為2H2+O2═2H2O,則正極為。組卷:45引用:2難度:0.7 -
25.按要求回答以下問題。
(1)已知1molNO2和1molCO反應生成CO2和NO過程中能量變化如圖所示。
請寫出NO2和CO反應的熱化學方程式。
(2)某溫度下在4L密閉容器中,X、Y、Z三種氣態物質的物質的量隨時間變化曲線如圖。
該反應的化學方程式是。
(3)在某容積為2L的密閉容器中充入0.5molNO2和1molCO,在一定條件下發生反應:NO2+CO?CO2+NO,2min時,測得容器中NO的物質的量為0.2mol,則:
①該段時間內,用CO2表示的平均反應速率為;
②下列事實能夠說明上述反應在該條件下已經達到化學平衡狀態的是(填字母序號)。
A.容器內氣體的質量保持不變
B.NO2的物質的量濃度不再改變
C.NO2的消耗速率與CO2的消耗速率相等
D.容器內氣體的物質的量保持不變
E.容器內氣體壓強保持不變組卷:18引用:1難度:0.7


