2021-2022學年四川省廣安市鄰水實驗學校高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每個小題只有一個選項符合題意,每小題2分,共48分)
-
1.中國政府承諾“努力爭取2060年前實現碳中和”,“碳中和”是使碳排放與碳吸收達平衡,實現二氧化碳相對“零排放”。為了實現碳中和,從實際出發,以下措施不可行的是( )
A.鼓勵拼車或乘坐公共交通出行 B.推廣垃圾分類處理,加強資源回收利用 C.禁止使用煤、石油等化石能源 D.采用物理或化學方法,捕集或吸收廢氣中的二氧化碳 組卷:4引用:1難度:0.6 -
2.最近《科學》雜志評出10大科技突破,其中“火星上找到水的影子”名列第一。下列關于水的說法中正確的是( )
A.水的電離過程需要通電 B.加入電解質一定會破壞水的電離平衡 C.pH=7的水一定呈中性 D.升高溫度,純水的pH值變小 組卷:100引用:7難度:0.6 -
3.下列事實能用勒夏特列原理解釋的是( )
A.工業合成氨選擇500℃ B.SO2氧化成SO3,需要使用催化劑 C.光照新制氯水時,溶液的顏色逐漸變淺 D.由NO2(g)和N2O4(g)組成的平衡體系,加壓后顏色加深 組卷:20引用:6難度:0.7 -
4.室溫下,往0.1mol/L的氨水中滴入酚酞試液時,溶液將呈現粉紅色.現采取下列措施,滴有酚酞的氨水溶液顏色不會變淺的是( )
A.往溶液中滴入稀硫酸 B.往溶液中加入NH4Cl晶體 C.把溶液加熱至沸騰 D.往溶液中加入NaOH固體 組卷:23引用:6難度:0.9 -
5.催化劑又稱觸媒,下列關于催化劑的說法正確的是( )
A.催化劑能加快反應速率是因為能改變反應熱 B.對可逆反應使用合適的催化劑能同等程度改變正、逆反應速率 C.催化劑反應前后的質量和性質不變 D.催化劑通過參與化學反應并改變化學反應路徑來起催化作用,但反應的活化能不變 組卷:112引用:6難度:0.8 -
6.下列關于活化分子和活化能的說法錯誤的是( )
A.活化分子間發生的碰撞一定是有效碰撞 B.能夠發生有效碰撞的分子稱為活化分子 C.普通分子獲得活化能后就成為了活化分子 D.活化能的作用在于使反應物活化來啟動反應 組卷:33引用:2難度:0.7 -
7.下列說法中正確的是( )
A.中和熱測定實驗時,如果沒有環形玻璃攪拌棒,可用環形銅質攪拌棒代替 B.向5mL0.02mol/LKMnO4酸性溶液中加入2mL0.1mol/L草酸,溶液紫紅色褪去 C.重鉻酸鉀溶液中滴加硫酸,溶液由黃色變橙色 D.用pH試紙測定溶液的pH值時,先把試紙放在待測液中,然后比色 組卷:4引用:1難度:0.5 -
8.用下列裝置進行相應實驗,能達到實驗目的的是( )
A. 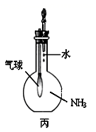
驗證氨氣的水溶性B. 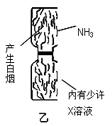
驗證X溶液為濃硫酸C. 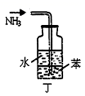
用于吸收尾氣NH3D. 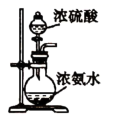
實驗室制少量氨氣組卷:5引用:2難度:0.5 -
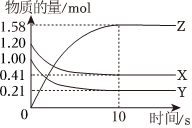 9.一定溫度下,在2L的密閉容器中,X,Y,Z三種氣體的物質的量隨時間變化的曲線如圖所示。下列描述正確的是( )
9.一定溫度下,在2L的密閉容器中,X,Y,Z三種氣體的物質的量隨時間變化的曲線如圖所示。下列描述正確的是( )A.0~10s內,Z的反應速率為0.158mol?L-1?s-1 B.反應開始到10s時,Y的轉化率為79.0% C.0~10s內,X的物質的量濃度減少了0.79 mol?L-1 D.反應的化學方程式為X(g)+Y(g)?Z(g) 組卷:9引用:3難度:0.5
二、填空題
-
27.(1)某研究性學習小組利用Na2S2O3溶液和稀硫酸溶液的反應探究濃度和溫度對化學反應速率的影響,進行了如表實驗:
①寫出該反應的離子方程式:實驗序號 實驗溫度/K 有關物質 渾濁所需時間/s 稀硫酸溶液 Na2S2O3溶液 H2O V/mL c/mol?L–1 V/mL c/mol?L–1 V/mL A 298 2 0.1 5 0.1 0 t 1 B T 1 2 0.1 4 0.1 V 1 8 C 313 2 0.1 V 2 0.1 1 t 2 。
②V1=、T1=;V2=。
(2)在微生物作用的條件下,NH4+經過兩步反應被氧化成NO3-。兩步反應的能量變化示意圖如圖: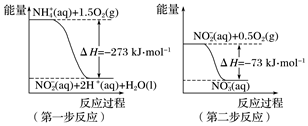
1 mol NH4+(aq)全部氧化成NO3-(aq)的熱化學方程式是。
(3)有人用圖3進行H2O2與MnO2反應的速率測定實驗。
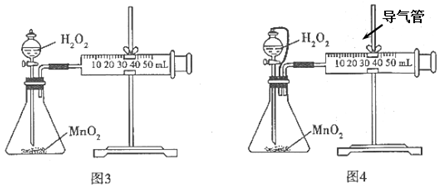
①檢查該裝置氣密性的方法是。
②有人認為可將裝置改進為圖4,你認為是否合理(選填“合理”或“不合理”)。組卷:4引用:2難度:0.6 -
28.(1)一定條件下,在體積為5L的密閉容器中,A、B、C三種氣體的物質的量n(mol)隨時間t(min)的變化如圖1所示。已知達到平衡后,降低溫度,A的體積分數將減小。
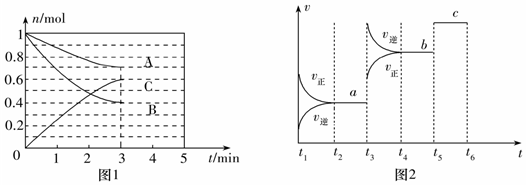
①該反應的化學方程式為,此反應平衡常數表達式為K=。
②該反應的△H0(填“>”“<”或“=”)。
③該反應的反應速率v隨時間t的變化關系如圖2所示:根據圖2判斷,在t3時刻改變的外界條件是。在恒溫恒容密閉容器中發生該反應,下列能作為達到平衡狀態的判斷依據是(填標號)。
a.體系壓強不變
b.氣體的平均摩爾質量保持不變
c.氣體的密度保持不變
d.A的消耗速率等于B的生成速率
(2)習近平主席在《中央城鎮化工作會議》發出號召:“讓居民望得見山、看得見水、記得住鄉愁”。消除含氮、硫、氯等化合物對大氣和水體的污染對建設美麗家鄉,打造宜居環境具有重要意義。NO2和CO是常見的環境污染氣體,汽車尾氣中CO、NO2在一定條件下可以發生反應:4CO(g)+2NO2(g)?4CO2(g)+N2(g) ΔH=1200kJ?mol-1。在一定溫度下,向容積固定為2L的密閉容器中充入一定量的CO和NO2,NO2的物質的量隨時間的變化曲線如圖所示。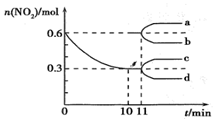
①從反應開始到10min的平衡狀態,N2的平均反應速率為。從11min起,其他條件不變,壓縮容器的容積為1L,則n(NO2)的變化曲線可能為圖中的(填字母)。
②對于該反應,溫度不同(T2>T1)、其他條件相同時,如圖表示正確的是(填序號)。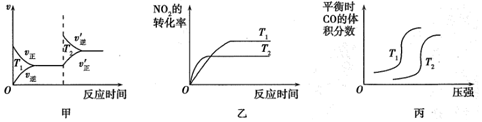
(3)甲醇是一種重要的化工原料,又是一種可再生能源,在開發和應用方面具有廣闊前景。在一容積為2L的密閉容器內,充入0.2mol CO與0.4mol H2發生反應CO(g)+2H2(g)?CH3OH(g),CO的平衡轉化率與溫度、壓強的關系如圖所示。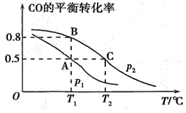
①p1p2(填“>”“<”或“=”)。
②在p1、T1℃時,該反應的壓強平衡常數Kp=。
③相同溫度下,在兩個相同的體積可變的容器a、b中分別投入容器a.0.1mol CO(g),0.2mol H2(g);容器b.0.2molCO(g),0.4molH2(g),0.1molCH3OH(g),則達到平衡后a、b容器的體積比為。組卷:47引用:1難度:0.6


