2020年天津市紅橋區高考化學模擬試卷(4月份)
發布:2024/11/9 6:30:2
一、選擇題(共12小題,每小題3分,滿分36分)
-
1.下列中國傳統工藝,利用氧化還原反應原理實現的是( )
選項 A.丹砂(HgS)煉汞 B.石灰水生產生石灰 C.酒精蒸餾 D.桑蠶絲織錦 工藝 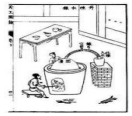



A.A B.B C.C D.D 組卷:103引用:8難度:0.9 -
2.下列化學用語書寫正確的是( )
A.中子數為7的碳原子是 C76B.基態Cr原子價電子排布式是3d44s2 C.乙烷的結構式是 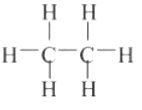
D.氯原子的結構示意圖是 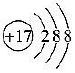 組卷:54引用:1難度:0.7
組卷:54引用:1難度:0.7 -
3.下列說法正確的是( )
A.原子半徑:P<S<Cl B.電負性:C<N<O C.熱穩定性:HF<HCl<HBr D.第一電離能:Na<Mg<Al 組卷:187引用:5難度:0.7 -
4.下列實驗操作,能達到實驗目的的是( )
A.用向下排空氣法收集NO B.用瓷坩堝加熱熔融NaOH固體 C.用濕潤的藍色石蕊試紙檢驗氨氣 D.用飽和NaHCO3溶液除去CO2中混有的少量SO2 組卷:31引用:1難度:0.5 -
5.下列說法不正確的是( )
A.雞蛋清遇醋酸鉛溶液發生鹽析 B.利用植物油的加成反應可以制得人造黃油 C.淀粉在體內最終水解為葡萄糖被人體吸收 D.75%的酒精可使蛋白質變性從而起到消毒作用 組卷:47引用:1難度:0.8
二、解答題(共4小題,滿分64分)
-
15.含氯消毒劑有多種,二氧化氯可用于自來水消毒,84消毒液用于家庭、賓館的消毒。
Ⅰ.實驗室可用亞氯酸鈉固體與氯氣反應制備ClO2:2NaClO2+Cl2═2ClO2+2NaCl,裝置如圖1所示: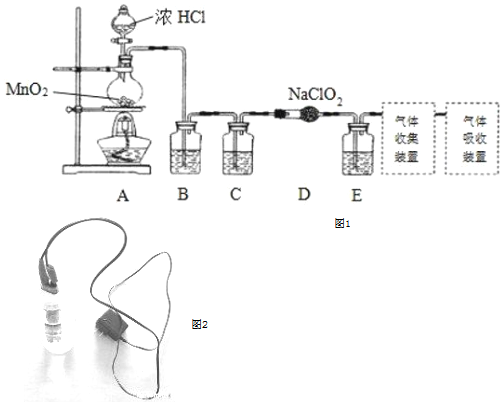
(1)裝置A中,盛裝濃鹽酸的儀器名稱為,開始反應后,圓底燒瓶內發生的反應的離子反應方程式為:。
(2)已知常溫常壓下,ClO2和Cl2是氣體,在不同溶劑中溶解性如表所示:B、C、E裝置中的試劑依次是ClO2 Cl2 水 極易溶于水 溶 CCl4 難溶 易溶 (填編號)
a.濃硫酸 b.飽和食鹽水 c.NaOH溶液 d.CCl4
(3)使用ClO2在給自來水消毒的過程中會產生有害的副產物亞氯酸根(ClO2-),可用Fe2+將其去除。已知ClO2-與Fe2+在pH=5~7的條件下能快速反應,最終形成紅褐色沉淀,而ClO2-則被還原成Cl-.Fe2+消除ClO2-的離子方程式為。
Ⅱ.某同學在家中自制出與“84消毒液”成分(NaClO和水)相同的消毒液。主要器材有6V變壓器、兩支木桿鉛筆、廢純凈水瓶、食鹽、衛生紙、絕緣膠布、小刀等。
(4)實驗過程:向一個廢棄的純凈水瓶中灌入大半瓶自來水,并加入3調味匙食鹽,用衛生紙將用鉛筆做成的電極包好,并插入純凈水瓶中,使電極恰好卡在瓶口,裝置如圖2,接通電源后,可以看到一側電極無明顯現象,另一側電極有細小的氣泡產生,請寫出該電極反應式為:;持續通電約3小時后,發現原先無明顯現象的電極附近也開始產生一定量的細小氣泡,此電極此時的電極反應式。看到該現象后停止通電。
(5)用該方法制備消毒液的總化學方程式是:。組卷:84引用:2難度:0.6 -
16.Cu及化合物在生產、國防中有重要的應用。
Ⅰ.納米級Cu2O既是航母艦艇底部的防腐蝕涂料,也是優良的催化劑。
(1)已知:Cu2O(s)+O2(g)═2CuO(s)△H=-196kJ?mol-112
2C(s)+O2(g)═2CO(g)△H=-220.8kJ?mol-1
則工業上用碳粉與CuO粉末混合在一定條件下反應制取Cu2O(s),同時生成CO氣體的熱化學方程式為:。
(2)用納米級Cu2O作催化劑可實現甲醇脫氫制取甲醛:CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡轉化率隨溫度變化曲線如圖3所示。
①該反應的△H0(填“>”或“<”);600K時,Y點甲醇的v(正)ν(逆)(填“>”或“<”)。
②在t1K時,向固定體積為1L的密閉容器中充入2mol CH3OH(g),溫度保持不變,9分鐘時達到平衡,則0~9min內用CH3OH(g)表示的反應速率v(CH3OH)=,溫度為t1時,該反應的平衡常數K的值為。
Ⅱ.Cu既是常見的催化劑,又是常見的電極材料。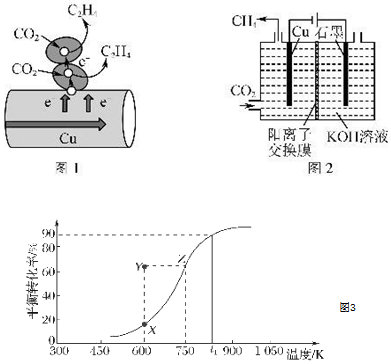
(3)圖1表示的是利用CO2的“直接電子傳遞機理”。在催化劑銅的表面進行轉化。當直接傳遞的電子物質的量為2mol時,則參加反應的CO2的物質的量為。
(4)圖2表示以KOH溶液作電解質溶液進行電解的示意圖,CO2在Cu電極上可以轉化為CH4,該電極反應的方程式為。
Ⅲ.含銅離子的廢水會造成污染,通常將其轉化為硫化銅沉淀而除去。
(5)已知:Ksp[CuS]=1×10-36,要使銅離子的濃度符合排放標準(不超過0.4mg/L),溶液中的硫離子的物質的量濃度至少為mol/L(保留至小數點后一位)。組卷:45引用:1難度:0.3


