2022-2023學(xué)年黑龍江省大慶實(shí)驗(yàn)中學(xué)高二(上)月考化學(xué)試卷(10月份)
發(fā)布:2024/4/20 14:35:0
一、單項(xiàng)選擇題(本題共18小題,每小題2分,共36分)
-
1.下列變化的ΔH<0的是( )
①水變成冰的過程
②干冰氣化的過程
③用于焊接鋼軌的鋁熱反應(yīng)
④赤熱的炭和水蒸氣作用制水煤氣的反應(yīng)A.①③ B.②③ C.②④ D.①④ 組卷:7引用:1難度:0.7 -
2.下列事實(shí)不能證明HNO2是弱電解質(zhì)的是( )
A.25℃時(shí)0.1mol?L-1HNO2溶液的pH=2.2 B.HNO2與NaHCO3反應(yīng)放出CO2氣體 C.滴入酚酞,NaNO2溶液顯紅色 D.25℃時(shí)pH=1的HNO2溶液稀釋至1000倍,pH<4 組卷:62引用:3難度:0.7 -
3.對于10mL1mol/L鹽酸與鋅粒的反應(yīng),下列措施能使生成H2速率加快的是( )
①適當(dāng)升高溫度(不考慮HCl揮發(fā));②改用10mL3mol/L硝酸;③改用30mL1mol/L醋酸;④用等量鋅粉代替鋅粒;⑤加入少量CuSO4固體⑥加入少量NaHSO4固體A.①④⑤⑥ B.①②④⑥ C.①③④⑤ D.①②③④⑥ 組卷:20引用:2難度:0.7 -
4.常溫下,下列離子組在指定環(huán)境中一定能大量共存的是( )
A.pH=13的溶液中:K+、CO32-、Na+、AlO2- B.使甲基橙變紅的溶液中:Fe2+、Na+、SO42-、NO3- C.c(H+)=10-10mol?L-1的溶液中:Al3+、NH4+、Cl-、NO3- D.水電離出來的c(H+)=1×10-12mol?L-1的溶液中:K+、HCO3-、Cl-、ClO- 組卷:16引用:3難度:0.7 -
5.在密閉容器中,一定條件下,進(jìn)行如下反應(yīng):NO(g)+CO(g)?
N2(g)+CO2(g)ΔH=-373.2kJ?mol-1,達(dá)到平衡后,為提高該反應(yīng)的速率和NO的轉(zhuǎn)化率,采取的正確措施是( )12A.加催化劑同時(shí)升高溫度 B.升高溫度同時(shí)充入N2 C.加催化劑同時(shí)增大壓強(qiáng) D.降低溫度同時(shí)增大壓強(qiáng) 組卷:17引用:2難度:0.5 -
6.用下列實(shí)驗(yàn)裝置進(jìn)行相應(yīng)實(shí)驗(yàn),能達(dá)到實(shí)驗(yàn)?zāi)康牡氖牵ā 。?br />
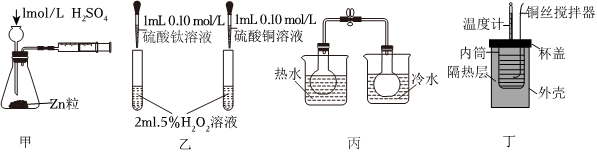
A.利用裝置甲測定化學(xué)反應(yīng)速率 B.利用裝置乙證明對H2O2分解反應(yīng)Fe3+催化效果好于Cu2+ C.利用裝置丙探究溫度對平衡2NO2(g)?N2O4(g)的影響 D.利用裝置丁測定0.55mol/L的NaOH溶液與0.5mol/L鹽酸反應(yīng)的中和熱 組卷:6引用:1難度:0.7 -
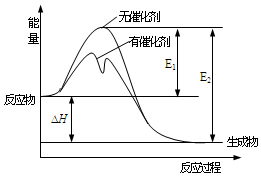 7.2SO2(g)+O2(g)?2SO3(g)反應(yīng)過程中的能量變化如圖所示(圖中E1表示無催化劑時(shí)正反應(yīng)的活化能,E2表示無催化劑時(shí)逆反應(yīng)的活化能)。下列有關(guān)敘述不正確的是( )
7.2SO2(g)+O2(g)?2SO3(g)反應(yīng)過程中的能量變化如圖所示(圖中E1表示無催化劑時(shí)正反應(yīng)的活化能,E2表示無催化劑時(shí)逆反應(yīng)的活化能)。下列有關(guān)敘述不正確的是( )A.該反應(yīng)中,反應(yīng)物的總鍵能小于生成物的總鍵能 B.ΔH=E1-E2,使用催化劑改變活化能,但不改變反應(yīng)熱 C.該反應(yīng)的逆反應(yīng)為吸熱反應(yīng),升高溫度可提高單位體積內(nèi)活化分子的百分?jǐn)?shù) D.一定條件下,將1molSO2(g)和0.5molO2(g)置于密閉容器中充分反應(yīng)生成SO3(g)放熱akJ,其熱化學(xué)方程式為2SO2(g)+O2(g)?2SO3(g)ΔH=-2akJ?mol-1 組卷:11引用:1難度:0.6 -
8.下列事實(shí),不能用勒夏特列原理解釋的是( )
A.用飽和食鹽水除去Cl2中的HCl氣體 B.用H2O2溶液制取氧氣時(shí)加入少量MnO2 C.工業(yè)合成氨采用200~500大氣壓的高壓條件 D.將氯化鐵溶液蒸干、灼燒,得到紅棕色的Fe2O3固體 組卷:16引用:3難度:0.7
三、非選擇題(本題共4小題)
-
25.鉻的化合物應(yīng)用廣泛,工業(yè)上以鉻鐵礦(FeCr2O4,含Al、Si氧化物等雜質(zhì))為主要原料制備Na2Cr2O7的工藝流程如圖。回答下列問題:
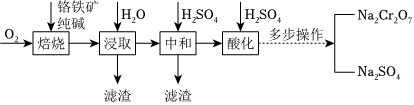
有關(guān)物質(zhì)的溶解度(g/100gH2O)如下表所示:
(1)為了提高焙燒速率,可采取的一種措施是溫度/℃ 20 40 60 80 100 Na2Cr2O7 183.6 215.1 269.2 376.4 415.0 Na2SO4 19.5 48.8 45.3 43.7 42.5 。
(2)焙燒的目的是將FeCr2O4轉(zhuǎn)化為Na2CrO4并將Al、Si氧化物轉(zhuǎn)化為可溶性鈉鹽,其中Si的氧化物發(fā)生反應(yīng)的化學(xué)方程式是。
(3)礦物中相關(guān)元素可溶性組分物質(zhì)的量濃度c與pH的關(guān)系如圖所示。當(dāng)溶液中可溶組分濃度c≤1.0×10-5mol?L-1時(shí),可認(rèn)為已除盡。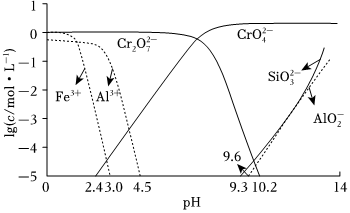
①中和時(shí)pH的理論范圍為。
②Fe元素在(填操作單元的名稱)過程中除去。
(4)“酸化”的目的是(從平衡移動(dòng)的角度回答)。
(5)“多步操作”包括蒸發(fā)濃縮、、過濾、洗滌等步驟。組卷:30引用:1難度:0.3 -
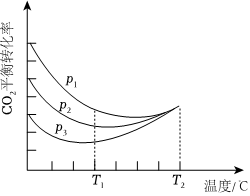 26.目前,大規(guī)模和低成本制取氫能實(shí)質(zhì)上都是通過烴重整實(shí)現(xiàn)的,該過程主要是甲烷水蒸氣重整,包括以下兩步氣相化學(xué)催化反應(yīng):
26.目前,大規(guī)模和低成本制取氫能實(shí)質(zhì)上都是通過烴重整實(shí)現(xiàn)的,該過程主要是甲烷水蒸氣重整,包括以下兩步氣相化學(xué)催化反應(yīng):
反應(yīng)Ⅰ:CH4(g)+H2O(g)?CO(g)+3H2(g)ΔH=+206kJ?mol-1
反應(yīng)Ⅱ:CO(g)+H2O(g)?CO2(g)+H2(g)ΔH=-41kJ?mol-1
(1)反應(yīng):CH4(g)+2H2O(g)?CO2(g)+4H2(g)自發(fā)進(jìn)行的條件是(“高溫”或“低溫”或“任意溫度”)。
(2)將2molCO和1molH2O充入某容積不變的絕熱密閉容器中,發(fā)生反應(yīng)Ⅱ。下列能判斷反應(yīng)Ⅱ達(dá)到平衡的是。
A.容器內(nèi)溫度不再變化
B.混合氣體的密度保持不變
C.容器內(nèi)壓強(qiáng)不再變化
D.斷2個(gè)O-H鍵同時(shí)形成2個(gè)C=O鍵
E.混合氣體的平均相對分子質(zhì)量保持不變
(3)甲烷水蒸氣重整得到的CO2與H2,可以催化重整制備CH3OCH3,制備的過程中存在反應(yīng):
①2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)ΔH<0;
②CO2(g)+H2(g)?C(g)+H2O(g)ΔH>0。
向密閉容器中以物質(zhì)的量之比為1:3充入CO2與H2,實(shí)驗(yàn)測得CO2的平衡轉(zhuǎn)化率隨溫度和壓強(qiáng)的變化關(guān)系如圖所示。P1、P2、P3由大到小的順序?yàn)?;T2℃時(shí)主要發(fā)生反應(yīng)(填“①”或“②”),CO2平衡轉(zhuǎn)化率隨溫度變化先降后升的原因?yàn)?。
(4)甲烷水蒸氣重整得到的CO2和H2也可用來制備甲醇,反應(yīng)方程式CO2(g)+3H2(g)?CH3OH(g)+H2O(g)ΔH<0,某溫度下,將1molCO2和3molH2充入體積不變的2L密閉容器中,初始總壓為8MPa,發(fā)生上述反應(yīng),測得不同時(shí)刻反應(yīng)后與反應(yīng)前的壓強(qiáng)關(guān)系如表:
①該條件下的分壓平衡常數(shù)為Kp=時(shí)間/h 1 2 3 4 5 p后p前0.92 0.85 0.79 0.75 0.75 (MPa)-2(用平衡分壓代替平衡濃度計(jì)算,分壓=總壓×物質(zhì)的量分?jǐn)?shù))。
②若該條件下v正=k正?c(CO2)?c3(H2),v逆=k逆?c(CH3OH)?c(H2O),其中k正、k逆為僅與溫度有關(guān)的速率常數(shù),=k正k逆(填數(shù)值)。組卷:46引用:1難度:0.7


