2020-2021學年黑龍江省哈爾濱六中高二(下)月考化學試卷(4月份)
發布:2024/4/20 14:35:0
一、單選題(每小題2分,共60分)
-
1.下列有關描述正確的是( )
A.第一電離能:Al>Mg>Na B.無機含氧酸的酸性:H2SO3<H2SO4<HClO4 C.電負性:F>N>O D.基態Cr原子的價電子排布圖: 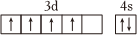 組卷:59引用:3難度:0.5
組卷:59引用:3難度:0.5 -
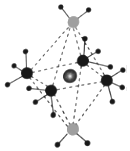 2.X、Y、Z、W為原子序數依次增大的前四周期元素,基態原子中,X為元素周期表中半徑最小的原子,Z原子最外層電子數為次外層電子數的三倍,W原子的價電子排布為3d104s1,X、Y、Z、W形成的陽離子如圖所示,下列說法正確的是( )
2.X、Y、Z、W為原子序數依次增大的前四周期元素,基態原子中,X為元素周期表中半徑最小的原子,Z原子最外層電子數為次外層電子數的三倍,W原子的價電子排布為3d104s1,X、Y、Z、W形成的陽離子如圖所示,下列說法正確的是( )A.原子半徑:Z>Y>X B.氣態氫化物的穩定性:Y>Z C.加熱時該離子首先失去的組分是X2Z D.兩種配體中的鍵角:X2Z>YX3 組卷:58引用:6難度:0.5 -
3.X、Y、Z、Q、E、M六種元素中,X的原子的基態價電子排布式為2s2,Y的基態原子核外有5種運動狀態不同的電子,Z元素的兩種同位素原子通常作為示蹤原子研究生物化學反應和測定文物的年代,Q是元素周期表中電負性最大的元素,E的陽離子通常存在于硝石、明礬和草木灰中,M的原子序數比E大1。下列說法正確的是( )
A.EYQ4中陰離子中心原子的雜化方式為sp2雜化 B.X、Y元素的第一電離能大小關系:X<Y C.ZO32-的空間構型為平面三角形 D.MZ2僅含離子鍵,可用于制備乙炔 組卷:33引用:4難度:0.5 -
4.下列說法中正確的是( )
①在基態多電子原子中,p軌道電子能量一定高于s軌道電子能量
②同一周期從左到右,元素的第一電離能、電負性都是越來越大
③PCl3和光氣(COCl2)分子中所有原子的最外層都達到8電子穩定結構
④所有的配合物都存在配位鍵,所有含配位鍵的化合物都是配合物
⑤所有含極性鍵的分子都是極性分子
⑥熔融狀態下能導電的化合物一定是離子化合物
⑦所有的原子晶體都不導電A.①② B.④⑥ C.③⑥ D.③⑦ 組卷:23引用:1難度:0.7 -
5.下列各項敘述中,正確的是( )
A.配合物Fe(CO)n內中心原子價電子數與配體提供電子總數之和為18,則n=6 B.價電子排布為ns1的元素,不一定是s區元素 C.水中的氫鍵可以表示為O-H…O,冰中每摩爾H2O有4NA個氫鍵 D.與基態鉀原子同周期且未成對電子數相同的元素還有4種 組卷:78引用:4難度:0.7 -
6.鈷的一種化合物的晶胞結構如圖所示,已知A點的原子坐標參數為(0,0,0),B點為(
,0,12)。下列說法中錯誤的是( )12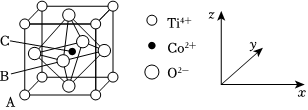
A.配合物中Co2+價電子排布式為3d7 B.鈷的配位數為6 C.C點的原子坐標參數為( ,12,12)12D.該物質的化學式為TiCoO2 組卷:134引用:6難度:0.4 -
7.正氰酸(H-O-C≡N)與異氰酸(H-N=C=O)、雷酸(H-O-N≡C)互為同分異構體,均可以與氨水形成相應銨鹽。下列說法錯誤的是( )
A.三種酸的分子均能形成分子間氫鍵 B.三種酸的分子中,氧原子的雜化方式相同 C.三種酸的組成元素中,碳的第一電離能最小 D.三種酸的銨鹽中,只有雷酸銨的陰、陽離子均含有配位鍵 組卷:54引用:5難度:0.7 -
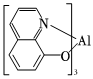 8.某種具有高效率電子傳輸性能的有機發光材料的結構簡式如圖所示。下列關于該材料組成元素的說法錯誤的是( )
8.某種具有高效率電子傳輸性能的有機發光材料的結構簡式如圖所示。下列關于該材料組成元素的說法錯誤的是( )A.五種組成元素中有四種元素位于p區且均位于同一周期 B.原子半徑:Al>C>N>O>H C.氣態氫化物的穩定性:H2O>NH3>CH4 D.基態N原子核外有7種運動狀態不同的電子 組卷:90引用:3難度:0.7 -
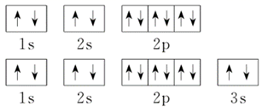 9.下列元素能形成XY2型化合物的是( )
9.下列元素能形成XY2型化合物的是( )
①原子序數分別為6和16的元素
②核內質子數分別為14和6的元素
③外圍電子排布式分別是3s2和3s23p5的基態原子
④軌道表示式分別為如圖所示的兩種元素的基態原子A.①②③④ B.①②③ C.①③ D.① 組卷:28引用:1難度:0.6 -
10.氨分子得到一個H+,變成銨離子(
)。下列對上述過程的描述不合理的是( )NH+4A.氮原子的雜化類型發生了改變 B.微粒的形狀發生了改變 C.微粒的化學性質發生了改變 D.微粒中的鍵角發生了改變 組卷:36引用:7難度:0.7 -
11.已知Zn2+的4s軌道和4p軌道可以形成sp3型雜化軌道,那么[ZnCl4]2-的空間構型為( )
A.直線形 B.平面正方形 C.正四面體形 D.正八面體型 組卷:243引用:20難度:0.7
二、填空題(共40分)
-
 33.短周期元素T、X、Y、Z的原子序數依次增大,其中元素T、X基態原子均有2個未成對電子,元素Y基態原子s能級的電子總數與p能級的電子總數相等,元素Z的價電子數等于電子層數。元素W位于第四周期,其基態原子所含未成對電子數在該周期中最多。
33.短周期元素T、X、Y、Z的原子序數依次增大,其中元素T、X基態原子均有2個未成對電子,元素Y基態原子s能級的電子總數與p能級的電子總數相等,元素Z的價電子數等于電子層數。元素W位于第四周期,其基態原子所含未成對電子數在該周期中最多。
(1)①元素X、Y、Z的第一電離能由大到小的順序為。(用元素符號表示)
②元素W在周期表中具體位置,元素Y在周期表區。
(2)T、X分別與氫組成的T2H2與H2X2分子中,T、X原子軌道的雜化類型分別是。
(3)T與X可形成TX32-離子和TX2分子。
①TX32-的空間構型為(用文字描述)。
②N3-離子與TX2分子互為等電子體,則N3-的電子式為。
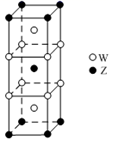
(4)如圖是由元素W、Z兩種元素所形成的某種合金的晶胞結構示意圖。
①元素W基態原子的核外電子排布式為。
②該合金中W與Z的原子個數比為。組卷:8引用:1難度:0.5 -
 34.鉑(Pt)可以和很多化合物形成配合物。生產生活中有重要的用途。
34.鉑(Pt)可以和很多化合物形成配合物。生產生活中有重要的用途。
(1)鉑和氨水可以形成配合物用于提取鉑。氨水中各元素的第一電離能從大到小的順序為。
(2)二氯二吡啶合鉑是由Pt2+、Cl-和吡啶結合形成的鉑配合物,有順式和反式兩種同分異構體,科學研究表明,反式分子和順式分子同樣具有抗癌活性。
①Cl-的核外電子排布式為。
②吡啶分子是大體積平面配體。其結構簡式為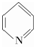 ,吡啶分子中氮原子的軌道雜化方式是,分子中的大π鍵可用符號Πmn表示,其中m代表參與形成大π鍵的原子數。n代表參與形成大π鍵的電子數。則吡啶中的大π鍵應表示為;1mol吡啶中含有σ鍵的數目為。
,吡啶分子中氮原子的軌道雜化方式是,分子中的大π鍵可用符號Πmn表示,其中m代表參與形成大π鍵的原子數。n代表參與形成大π鍵的電子數。則吡啶中的大π鍵應表示為;1mol吡啶中含有σ鍵的數目為。
③二氯二吡啶合鉑分子中存在的微粒間作用力有(填字母)。
a.離子鍵
b.配位鍵
c.金屬鍵
d.非極性鍵
e.氫鍵
f.極性鍵
④二氯二吡啶合鉑分子中,Pt2+的配位數是4,但是其軌道雜化方式并不是sp3。
簡述理由:。
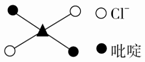
⑤反式二氯二吡啶合鉑分子結構如圖所示,該分子是分子(填“極性”或“非極性”)。組卷:14引用:1難度:0.6


