2022-2023學年浙江省杭州市八校聯盟高二(上)期中化學試卷
發布:2024/9/7 1:0:8
一、選擇題1(本大題共15小題,每個小題列出的四個備選項中,只有一個是符合題目要求的,不選、多選、錯選均不得分,每小題2分,共30分)
-
1.下列物質中屬于強電解質的是( )
A.CH3COOH B.C2H5OH C.NaCl D.H2O 組卷:45引用:4難度:0.9 -
 2.用0.1026mol?L-1的鹽酸滴定25.00mL未知濃度的氫氧化鈉溶液,滴定達終點時,滴定管中的液面如圖所示,正確的讀數為( )
2.用0.1026mol?L-1的鹽酸滴定25.00mL未知濃度的氫氧化鈉溶液,滴定達終點時,滴定管中的液面如圖所示,正確的讀數為( )A.22.30mL B.22.35mL C.23.65mL D.23.70mL 組卷:408引用:18難度:0.9 -
3.下列反應屬于吸熱反應的是( )
A.CaO+H2O═Ca(OH)2 B.Mg+2HCl═MgCl2+H2↑ C.H2SO4+2KOH═K2SO4+2H2O D.2H2O 2H2↑+O2↑通電組卷:47引用:4難度:0.8 -
4.下列物質的水溶液因水解而顯堿性的是( )
A.NH4Cl B.Na2CO3 C.NaOH D.NH3 組卷:71引用:3難度:0.3 -
5.下列說法正確的是( )
A.2H2O2(aq)═2H2O (1)+O2(g) ΔH=-189.3kJ?mol-1 任何溫度均可正向自發進行 B.反應ΔH>0,一定不能自發進行 C.向水中加入NH4NO3固體,溶液溫度降低,可說明銨鹽水解是吸熱的 D.ΔH>0,ΔS<0的反應在任何溫度下均能正向自發進行 組卷:6引用:1難度:0.8 -
6.在2A+B?3C+4D反應中,表示該反應速率最快的是( )
A.v(A)=0.5mol?L-1?s-1 B.v(B)=0.3mol?L-1?s-1 C.v(C)=0.8mol?L-1?s-1 D.v(D)=1mol?L-1?s-1 組卷:232引用:82難度:0.7 -
7.下列電離方程式中正確的是( )
A.NaHSO4溶于水:NaHSO4?Na++H++ SO2-4B.次氯酸電離:HClO═ClO-+H+ C.HF溶于水:HF+H2O?H3O++F- D.NH4Cl溶于水: +H2O?NH3?H2O+H+NH+4組卷:224引用:9難度:0.9 -
8.某溫度時,濃度都是1mol?L-1的兩種氣體X2和Y2,在密閉容器中發生可逆反應生成氣體Z,充分反應后X2的濃度為0.4mol?L-1,Y2的濃度為0.6mol?L-1,生成的Z的濃度為0.4mol?L-1,則該反應的化學方程式(Z用X、Y表示)是( )
A.X2+2Y2?2XY2 B.3X2+2Y2?2X3Y2 C.X2+3Y2?2XY3 D.3X2+Y2?2X3Y 組卷:24引用:2難度:0.7 -
9.50℃時水的離子積Kw=3.0×10-14,則在50℃時,c(OH-)=1×10-7mol?L-1的溶液( )
A.呈酸性 B.呈堿性 C.呈中性 D.無法判斷 組卷:9引用:1難度:0.8 -
10.下列關于常溫下的電解質溶液的說法正確的是( )
A.35℃時,純水中c(H+)>c(OH-) B.向0.1mol?L-1CH3COOH溶液加水稀釋時會引起溶液中c(OH-)減小 C.電離平衡右移,弱電解質的電離程度一定增大 D.除了水的電離平衡外,鹽酸中不存在其他電離平衡 組卷:27引用:2難度:0.5
二、非選擇題(本大題共5小題,共40分)
-
29.某學生用0.1000mol/LKOH溶液滴定未知濃度的鹽酸溶液,其操作可分解為如下幾步:
①移取25.00mL待測的鹽酸溶液注入潔凈的錐形瓶,并加入2~3滴酚酞
②用標準溶液潤洗滴定管2~3次
③把盛有標準溶液的滴定管固定好,調節液面使滴定管尖嘴充滿溶液
④取標準KOH溶液注入至0刻度以上2~3cm
⑤調節液面至0或0刻度以下,記下讀數
⑥把錐形瓶放在滴定管的下面,用標準KOH溶液滴定至終點,記下滴定管液面的刻度
(1)正確操作的順序是(用序號填寫)。
(2)步驟④中的滴定管是:(填“酸式滴定管”或“堿式滴定管”)。
(3)當步驟⑥待測液由色變為色,且半分鐘內不變化即達到終點,KOH 溶液開始時讀數及恰好反應時的讀數見表。
請計算待測的鹽酸的物質的量濃度實驗編號 待測鹽酸溶液體積(ml) 滴定開始讀數(ml) 滴定結束讀數(ml) ① 25.00 0.00 19.95 ② 25.00 1.10 18.30 ③ 25.00 0.20 20.25 mol/l(小數點后面保留4位數字)。
(4)由于操作失誤,使得上述所測鹽酸溶液的濃度偏高的是。
A.滴定達到終點時,俯視滴定管內液面讀數
B.堿式滴定管用蒸餾水洗凈后立即取用氫氧化鉀溶液進行滴定
C.錐形瓶用蒸餾水洗凈后未干燥就裝入鹽酸待測液
D.滴定時堿式滴定管中氫氧化鉀溶液灑落在錐形瓶外組卷:14引用:6難度:0.6 -
30.在2020年中央經濟工作會議上,我國明確提出“碳達峰”與“碳中和”目標,因此利用煤炭或CO2合成其它高價值化學品的工業生產顯得更加重要。
(1)工業上以煤和水為原料通過一系列轉化可獲得清潔能源氫氣。
已知:①C(s)+O2(g)═CO2(g)△H1=-393.5kJ?mol-1
②2H2(g)+O2(g)═2H2O(1)△H2=-571kJ?mol-1
③H2O(l)═H2O(g)△H3=+41kJ?mol-1
則碳與水蒸氣反應C(s)+2H2O(g)CO2+2H2(g)的△H=高溫。
(2)工業.上也可以僅利用上述反應得到的CO2和H2進一步合成甲醇:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
①在某恒溫恒容密閉容器中充入1mol CO2和3mol H2發生反應,測得CO2和CH3OH(g)濃度隨時間變化如下圖1所示。則平衡時H2(g)的轉化率為,該溫度下的平衡常數為L2/mol2。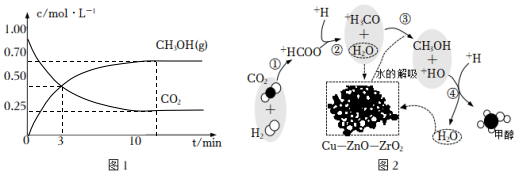
②該反應在催化劑Cu-ZnO-ZrO2表面進行,主反應歷程如圖2所示(催化劑表面吸附的物種用?標注),下列說法不正確的是。
A.該反應的原子利用率為100%
B.催化劑可以降低反應活化能
C.反應②中,斷裂和形成的共價鍵至少有2種
D.使用催化劑可以提高反應的轉化率
(3)將合成的甲醇進行水蒸氣重整是電動汽車氫氧燃料電池理想的氫源。該制氫(SRM)系統簡單,產物中H2含量高、CO含量低(CO會損壞燃料電池的交換膜),反應如下:
反應Ⅰ(主):CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H1>0
反應Ⅱ(副):H2(g)+CO2(g)?CO(g)+H2O(g)△H2>0
溫度高于300℃會同時發生反應Ⅲ:CH3OH(g)?CO(g)+2H2(g)
①反應1能夠自發進行的原因是。
②升溫有利于提高CH3OH轉化率,但也存在一個明顯的缺點是。
③寫出一條能提高CH3OH轉化率而降低CO生成率的措施。組卷:13引用:3難度:0.4


