2021-2022學年黑龍江省黑河市嫩江高級中學等部分學校高一(下)第一次月考化學試卷
發(fā)布:2024/12/23 2:30:2
一、選擇題:本題共20個小題,1-10題每小題2分。11-20題每小題2分,在每小題給出的四個選項中,只有一項是符合題目要求的。
-
 1.2022年北京冬奧會秉承“綠色辦奧”、“科技辦奧”理念,火炬“飛揚”首創(chuàng)以復合碳纖維為外殼材料,以氫氣為燃料,在出火口格柵噴涂堿金屬。下列說法正確的是( )
1.2022年北京冬奧會秉承“綠色辦奧”、“科技辦奧”理念,火炬“飛揚”首創(chuàng)以復合碳纖維為外殼材料,以氫氣為燃料,在出火口格柵噴涂堿金屬。下列說法正確的是( )A.碳纖維是一種新型有機材料 B.選擇氫氣主要是考慮其燃點低、易壓縮 C.多地禁放煙花以降低空氣質量指數(shù)級別 D.噴涂堿金屬目的是利用焰色反應(化學變化)讓火焰可視化 組卷:22引用:1難度:0.8 -
2.化學與生活、科技等緊密相關,下列說法錯誤的是( )
A.《呂氏春秋別類》中“金(即銅)柔錫柔,合兩柔則鋼”,體現(xiàn)合金硬度的特性 B.中國空間站天宮授課展示了許多有趣的實驗,過濾要比溶解、蒸發(fā)更難進行 C.K2FeO4和明礬都可做水處理劑,二者的凈水原理完全相同 D.春秋初年秦國的銅柄鐵劍說明我國當時已經初步掌握冶鐵技術 組卷:28引用:2難度:0.6 -
3.下列有關化學用語的表示方法中正確的是( )
A.次氯酸的電子式: 
B.M2+離子核外有a個電子,b個中子,M原子符號為 Ma+b+2a+2C.用電子式表示MgCl2的形成過程為: 
D.過氧化氫電子式:  組卷:39引用:3難度:0.6
組卷:39引用:3難度:0.6 -
4.將SO2和X氣體分別通入BaCl2未見沉淀產生,若將兩者同時通入則產生沉淀,那么X不可能是( )
A.CO2 B.NH3 C.H2S D.Cl2 組卷:19引用:2難度:0.7 -
5.下列有關硫及其化合物的說法中正確的是( )
A.濃硫酸具有吸水性,可做干燥劑,不能干燥NH3,也不能干燥H2S等還原性氣體 B.濃硫酸與灼熱的炭反應,體現(xiàn)了濃硫酸的強氧化性和酸性 C.SO2和Cl2均可使品紅溶液褪色,但將溶有SO2的品紅溶液加熱后又恢復紅色,說明SO2的氧化性沒有Cl2強 D.以 FeS2為原料生產硫酸過程中,要用到沸騰爐、接觸室、吸收塔等設備,所涉及的反應均為氧化還原反應 組卷:66引用:2難度:0.5 -
6.在稀硫酸中幾種離子的轉化關系如圖所示。

下列說法正確的是( )A.反應1中氧化劑為Mn3+ B.氧化性:Ce4+>Fe3+>I2>Mn3+ C.推測可發(fā)生反應:2Mn3++2I-=I2+2Mn2+ D.反應2的氧化劑為Mn3+,還原產物為Fe3+ 組卷:151引用:6難度:0.7 -
7.碳酸鑭La2(CO3)3難溶于水,常用于慢性腎衰竭患者高磷酸鹽血癥的治療。實驗室將CO2、NH3通入LaCl3溶液中反應制備碳酸鑭,實驗裝置如圖所示(夾持裝置已略去),下列說法錯誤的是( )
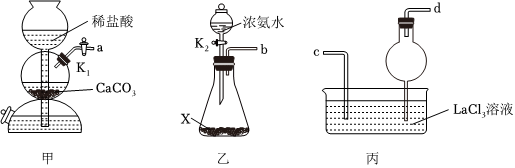
A.X可以是堿石灰,生石灰或燒堿 B.甲中的a口接丙中的c口,乙中的b口接丙中的d口 C.丙中應先通入CO2,再通入NH3 D.丙中反應的離子方程式為2La3++6NH3+3CO2+3H2O=La2(CO3)3↓+6 NH+4組卷:13引用:5難度:0.6 -
8.設NA為阿伏加德羅常數(shù)的值。下列有關敘述正確的是( )
A.硝酸與銅反應得到NO2、N2O4共23g,則銅失去的電子數(shù)為0.5NA B.常溫下,8.1g鋁片與足量的濃硝酸反應,轉移電子數(shù)為0.9NA C.常溫常壓下,水蒸氣通過Na2O2使其增重2g時,反應中轉移的電子數(shù)為2NA D.高溫高壓下,28gN2與4molH2充分反應,生成的NH3為2NA 組卷:18引用:4難度:0.6
二、非選擇題:(第21題~第24題4個大題,每空2分,共50分。)
-
23.節(jié)日期間因燃放鞭炮會引起空氣中SO2含量增大,造成大氣污染。某實驗小組同學欲探究SO2的性質并測定空氣中SO2的含量。
(1)他們設計如圖1所示實驗裝置,請你參與探究,并回答下列問題:
①裝置A1中發(fā)生反應的化學方程式為;
②裝置B用于SO2檢驗的漂白性,其中所盛試劑為,裝置D中發(fā)生反應的化學方程式為,說明SO2具有性;
③C中發(fā)生的離子方程式為:;
④為了實現(xiàn)綠色環(huán)保的目標,甲同學欲用裝置A2代替裝置A1你認為裝置A2的優(yōu)點是。
(2)擬用如圖2兩裝置測定空氣中SO2含量(忽略空氣中其他還原性氣體的干擾)。
①通過討論,不能采用裝置b,其原因是;
②若通入VL(標準狀況下)空氣(M=29g/mol),恰好與145mL 0.25mol/L高錳酸鉀溶液完全反應,則空氣中SO2的質量分數(shù)為%。(寫出含V的表達式)組卷:9引用:2難度:0.5 -
24.用如下方法回收廢舊CPU中的單質Au(金),Ag和Cu。

已知:
①濃硝酸不能單獨將Au溶解。
②HAuCl4?H++AuCl-4
(1)酸溶后經操作,將混合物分離。
(2)濃、稀HNO3均可作酸溶試劑。溶解等量的Cu消耗HNO3的物質的量不同,寫出消耗HNO3物質的量少的反應的化學方程式:
(3)HNO3-NaCl與王水[V(濃硝酸):V(濃鹽酸)=1:3]溶金原理相同。
①將溶金反應的化學方程式補充完整:Au+NaCl+HNO3═HAuCl4+++NaNO3
②關于溶金的下列說法正確的是。
A.用到了HNO3的氧化性
B.王水中濃鹽酸的主要作用是增強溶液的酸性
C.用濃鹽酸與NaNO3也可使Au溶解
(4)若用Zn粉將溶液中的1mol HAuCl4完全還原,則參加反應的Zn的物質的量是mol。
(5)用適當濃度的鹽酸、NaCl溶液、氨水與鐵粉,可按照如下方法從酸溶后的溶液中回收Cu和Ag(圖中標注的試劑和物質均不同)。試劑1是;試劑2是。 組卷:536引用:9難度:0.4
組卷:536引用:9難度:0.4


