2022-2023學年甘肅省蘭州市西北師大附中高三(上)期中化學試卷
發(fā)布:2024/4/20 14:35:0
一、單選題(本大題共26小題,每題3分,共78分)
-
1.化學在生產(chǎn)、生活中起著重要的作用,以下化學用語中正確的是( )
A.補鐵劑通常需要與維C共同使用,是為了增強藥品中Fe3+的效果 B.侯氏制堿法中利用各個物質溶解度的不同,可直接過濾獲得純堿 C.向冷的石灰乳中通入氯氣,可制得漂白粉,有效成分為次氯酸鈣 D.不銹鋼是最常見的一種合金鋼,它的合金元素主要是錳和鎳 組卷:40引用:2難度:0.8 -
2.阿伏加德羅常數(shù)的值為NA。下列說法正確的是( )
A.0.1molNaCl在乙醇中形成的膠體含有的膠粒數(shù)目為0.1NA B.100g46%乙醇溶液中含有的H—O鍵的數(shù)目為NA C.常溫下,5.6gFe與足量 16mol/LHNO3溶液充分反應,轉移電子數(shù)為0.3NA D.0.1molH2和0.1mol I2于密閉容器中充分反應后,其分子總數(shù)為0.2NA 組卷:1引用:2難度:0.6 -
3.下列反應的離子方程式書寫正確的是( )
A.向H2O2溶液中滴加少量FeCl3溶液:2Fe3++H2O2═O2↑+2H++2Fe2+ B.CuSO4溶液中滴加稀氨水:Cu2++2OH-═Cu(OH)2↓ C.使用K3[Fe(CN)6]溶液檢驗Fe2+:2[Fe(CN)6]3-+3Fe2+═Fe3[Fe(CN)6]2↓ D.將等濃度的Ba(OH)2溶液與NaHSO4溶液按體積比1:2混合:2Ba2++2SO42-+3H++3OH?═2BaSO4↓+3H2O 組卷:79引用:3難度:0.7 -
4.向H2O2溶液中加入Br2可以加快H2O2分解速率。其反應機理可能有兩步,第1步:H2O2+Br2═2H++O2↑+2Br-。下列說法正確的是( )
A.H2O2分子中含有離子鍵和非極性鍵 B.第2步反應為:2H2O2+2Br-═2H2O+Br2+O2↑ C.第1步反應每生成0.1mol O2,轉移0.2mol電子 D.該反應機理中,Br-催化H2O2分解產(chǎn)生O2 組卷:47引用:4難度:0.8 -
5.下列敘述中正確的是( )
A.某物質熔融狀態(tài)能導電,可以證明該物質內一定存在離子鍵 B.單質分子中一定含有非極性共價鍵 C.離子鍵就是使陰陽離子結合成化合物的靜電引力 D.共價化合物中,一定存在極性共價鍵,可能存在非極性鍵,一定不存在離子鍵 組卷:45引用:1難度:0.8 -
6.下列說法正確的是( )
①Na2O2投入到紫色石蕊試液中,溶液先變藍,后褪色;
②質量相等的NaHCO3與Na2CO3分別與足量鹽酸完全反應時,產(chǎn)生CO2物質的量相等;
③取agNa2CO3和NaHCO3混合物與足量稀硫酸充分反應,逸出氣體用堿石灰吸收,增重bg,能測定和NaHCO3混合物中Na2CO3質量分數(shù);
④區(qū)別NaHCO3與Na2CO3溶液,可用Ca(OH)2溶液;
⑤NaHCO3固體可以做干粉滅火劑,金屬鈉起火可以用它來滅火;
⑥NaHCO3粉末中混有Na2CO3,可配制成溶液通入過量的CO2,再低溫結晶提純得到。A.①⑥ B.②⑤ C.②④ D.③④ 組卷:29引用:1難度:0.6 -
7.ag鎂鋁合金投入xmL2mol/L的鹽酸中,一段時間后金屬完全溶解,再加入ymL1mol/L的NaOH溶液,沉淀達到最大值,其質量為(a+1.7)g,則下列說法中不正確的是( )
A.鎂鋁合金與鹽酸反應轉移電子數(shù)為0.1NA B.y一定等于100 C.產(chǎn)生的H2在標準狀況下體積為1.12L D.a(chǎn)的取值范圍為0.9<a<1.2 組卷:19引用:3難度:0.5 -
8.堿式硫酸鐵[Fe(OH)SO4]是一種絮凝劑,常用于污水處理。工業(yè)上利用廢鐵屑(含少量Al2O3、Fe2O3等)生產(chǎn)堿式硫酸鐵的工藝流程如圖所示。下列說法錯誤的是( )
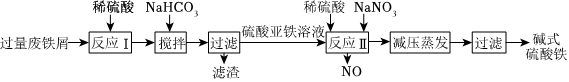
A.“反應Ⅰ”后的溶液中主要存在的陽離子有H+、Fe2+、Al3+ B.“反應Ⅱ”中加入稀硫酸可抑制Fe3+的水解 C.“反應Ⅱ”對應的離子方程式為Fe2++ +2H+═Fe3++NO↑+H2ONO-2D.若用O2代替NaNO2,則每消耗112mL(標準狀況)O2相當于節(jié)約了2.76g NaNO2 組卷:30引用:5難度:0.5 -
9.2020年9月,研究人員在金星大氣中探測到了磷化氫(PH3)氣體。PH3常作為一種熏蒸劑,在貯糧中用于防治害蟲,一種制備PH3的流程如圖所示,下列說法正確的是( )
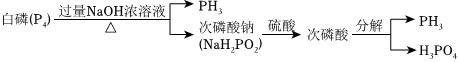
A.理論上,1mol白磷可生產(chǎn)2molPH3 B.流程中,PH3屬于氧化產(chǎn)物 C.白磷與濃NaOH溶液反應的化學方程式P4+3NaOH+3H2O═PH3↑+3NaH2PO2 D.次磷酸的分子式為H3PO2,屬于三元酸 組卷:12引用:3難度:0.5 -
10.下列方案設計、現(xiàn)象和結論都正確的是( )
目的 方案設計 現(xiàn)象和結論 A 驗證NaCl、Na2SO4、NaOH混合溶液中的Cl- 取混合溶液于試管中,加入過量硝酸酸化的Ba(NO3)2溶液充分反應,靜置,向上層清液中滴加AgNO3溶液 若上層清液變渾濁。則混合溶液中含有Cl- B 證明H2O2有氧化性 將足量的H2O2溶液滴入酸性高錳酸鉀溶液中 若溶液中的紫紅色褪去、則證明H2O2有氧化性 C 驗證SO2的漂白性 將SO2氣體通入滴有酚酞的氫氧化鈉溶液中 若溶液紅色消失,則證明SO2有漂白性 D 提純收集干燥純凈的N2(雜質O2、CO2) 將混合氣體依次通過足量的氫氧化鈉溶液、灼熱的氧化銅、濃硫酸,最后用真空氣囊收集 收集到純凈干燥的N2 A.A B.B C.C D.D 組卷:4引用:2難度:0.5
二、非選擇題(每空2分,共72分)
-
29.亞硝酸鈣是白色粉末,易潮解,易溶于水,微溶于乙醇、乙醚。實驗室用NO和CaO2(淡黃色固體)制備無水亞硝酸鈣的裝置(夾持裝置略)如圖所示。
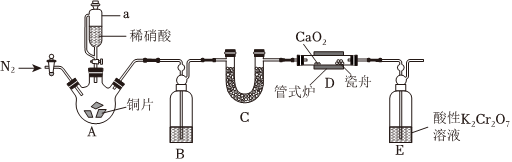
回答下列問題:
(1)實驗開始先通N2,一段時間后,向三頸燒瓶中滴加稀硝酸制取NO,B中產(chǎn)生大量氣泡時,D處開始加熱。儀器a的名稱為,B中盛放的試劑是。
(2)裝置E中,酸性K2Cr2O7可將剩余的NO氧化為,溶液逐漸由橙色變?yōu)榫G色(Cr3+),該反應的離子方程式為NO-3。
(3)上述裝置存在一處缺陷,會導致亞硝酸鈣產(chǎn)率降低,改進的方法是。
(4)CaO2完全還原后,進行的操作是:①停止滴加稀硝酸,停止通電;②??????;③冷卻后,將所得產(chǎn)品完全轉移到試劑瓶中密封保存;④??????,其中操作②是。
(5)測定所得亞硝酸鈣中硝酸鈣的含量。
實驗原理:Ca2++═CaSO4↓;SO2-4+NO-2NH+4N2↑+2H2O;△+3Fe2++4H+═3Fe3++NO↑+2H2O;Cr2NO-3+6Fe2++14H+═6Fe3++2Cr3++7H2O。O2-7
實驗步驟:Ⅰ.準確稱取mg所得亞硝酸鈣,置于150mL燒杯中,加入100mL蒸餾水和ng硫酸鈉(足量),攪拌均勻,將溶液與沉淀全部移入250mL容量瓶,加入稀釋至刻度,搖勻,過濾;(忽略固體對溶液體積的影響)
Ⅱ.取25.00mL濾液于500mL錐形瓶中,加入足量NH4Cl飽和溶液,煮沸5min;
Ⅲ.冷卻后用少量蒸餾水洗滌錐形瓶內壁,再加入25.00mLamol?L-1硫酸亞鐵銨[(NH4)2SO4?FeSO4]溶液,在不斷搖動下,沿瓶壁緩慢加入20mL硫酸(1:1)。
Ⅳ.加4滴指示劑,迅速用cmol?L-1K2Cr2O7標準液滴定至終點,消耗K2Cr2O7標準液VmL。
所得亞硝酸鈣中硝酸鈣的質量百分含量為;
下列情況會導致硝酸鈣的質量百分含量測量值偏大的是(填標號)。
a.步驟Ⅰ中,稱量后樣品發(fā)生了潮解
b.步驟Ⅱ中,煮沸時間僅有3min
c.步驟Ⅲ中量取的硫酸亞鐵銨溶液的實際體積小于25.00mL
d.滴定終點時,發(fā)現(xiàn)尖嘴管內有氣泡生成組卷:6引用:1難度:0.4 -
30.氮的化合物應用廣泛。
(1)Reineckesalt的結構如圖所示: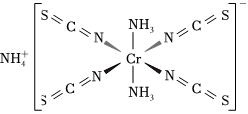
其中配位原子為(填元素符號),陽離子的空間結構為,NCS-中碳原子雜化方式為。
(2)重鉻酸銨[(NH4)2Cr2O7]為桔黃色單斜結晶,常用作有機合成催化劑,Cr2的結構如圖。O2-7
(NH4)2Cr2O7中N、O、Cr三種元素第一電離能由大到小的順序是(填元素符號),1mol該物質中含σ鍵的數(shù)目為NA。
(3)[Zn(IMI)4](ClO4)2是Zn2+的一種配合物,IMI的結構為 IMI的某種衍生物與甘氨酸形成的離子化合物(
IMI的某種衍生物與甘氨酸形成的離子化合物(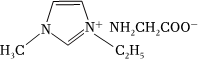 )常溫下為液態(tài)而非固態(tài),原因是 。
)常溫下為液態(tài)而非固態(tài),原因是 。
(4)已知:多原子分子中,若原子都在同一平面上且這些原子有相互平行的p軌道,則p電子可在多個原子間運動,形成“離域π鍵”(或大π鍵)。大π鍵可用Πmn表示,其中m、n分別代表參與形成大π鍵的原子個數(shù)和電子數(shù),如苯分子中大π鍵表示為Π66。
①下列微粒中存在“離域Π鍵”的是。
A.CH2=CH-CH=CH2
B.CCl4
C.H2O
D.SO2
②NaN3中陰離子與CO2互為等電子體,均為直線型結構,N-3中的2個大π鍵可表示為N-3。
(5)符號“3px”沒有給出的信息是。
A.能層
B.能級
C.電子云在空間的伸展方向
D.電子的自旋方向
(6)下列實驗事實不能用氫鍵來解釋的是。
A.CH4比SiH4穩(wěn)定
B.乙醇能與水以任意比互溶
C.鄰羥基苯甲醛的沸點低于對羥基苯甲醛
D.接近沸點的水蒸氣的相對分子質量測量值大于18
(7)下列圖象是NaCl、CsCl、ZnS等離子晶體結構圖或者是從其中分割出來的部分結構圖。其中屬于NaCl的晶體結構的圖是。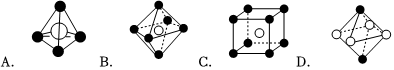
(8)鍵能的大小可以衡量化學鍵的強弱。下列說法中錯誤的是。
A.SiCl4的熔點比SiC熔點低化學鍵 Si-O Si-Cl H-H H-Cl Si-Si Si-C 鍵能/kJ?mol-1 460 360 436 431 176 347
B.HCl的穩(wěn)定性比HI穩(wěn)定性高
C.C-C的鍵能大于Si-Si
D.拆開1mol晶體硅中的化學鍵所吸收的能量為176kJ組卷:45引用:1難度:0.3


