2022-2023學年遼寧省沈陽120中高二(上)第一次質檢化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題共15小題,每小題3分,共45分。在每小題給出的四個選項中,只有一項符合題目要求)
-
1.生活中處處有化學,下列有關說法正確的是( )
A.天然弱堿性水呈堿性的原因是其中含有較多的Mg2+、Ca2+等離子 B.焊接時用NH4Cl溶液除銹與鹽類水解無關 C.生活中用電解食鹽水的方法制取消毒液,運用了鹽類的水解原理 D.在滴有酚酞的Na2CO3溶液中慢慢滴入BaCl2溶液,溶液的紅色逐漸褪去 組卷:122引用:8難度:0.9 -
2.能正確表示下列變化的離子方程式是( )
A.用銀作電極電解稀鹽酸:2Ag+2H++2Cl- H2↑+2AgCl電解B.在水溶液中NaHCO3的水解方程式:HCO3-+H2O?H3O++CO32- C.方鉛礦(PbS)遇CuSO4溶液生成銅藍(CuS):Cu2+(aq)+PbS(s)═CuS(s)+Pb2+(aq) D.泡沫滅火器原理:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- 組卷:48引用:4難度:0.5 -
3.下列說法錯誤的是( )
A.pH=1的強酸溶液,加水稀釋后,溶液中各離子濃度都會降低 B.pH=2的一元酸和pH=12的二元強堿等體積混合:c(OH-)≤c(H+) C.pH相等的三種溶液:a.CH3COONa;b.NaHCO3;c.NaOH,則三種溶液的溶質的物質的量濃度由小到大順序為:c<b<a D.pH=4、濃度均為0.1mol/L的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) 組卷:150引用:3難度:0.7 -
 4.科學工作者研發了一種SUNCAT的系統,借助鋰循環可持續合成氨,其原理如圖所示。下列說法錯誤的是( )
4.科學工作者研發了一種SUNCAT的系統,借助鋰循環可持續合成氨,其原理如圖所示。下列說法錯誤的是( )A.過程Ⅰ得到的Li3N中N元素-3價 B.過程Ⅱ生成W的反應為Li3N+3H2O═3LiOH+NH3↑ C.過程Ⅲ涉及的反應為4OH--4e-═O2↑+2H2O D.過程Ⅲ中能量的轉化形式為化學能轉化為電能 組卷:4引用:1難度:0.8 -
5.關于如圖所示各裝置的敘述中,正確的是( )

A.圖1是原電池,總反應是:Cu+2Fe3+═Cu2++2Fe2+ B.圖2可驗證鐵的吸氧腐蝕,負極反應式為:Fe-2e-═Fe2+ C.圖3裝置可在待鍍鐵件表面鍍銅 D.裝置④中鋼閘門應與外接電源的負極相連被保護,該方法叫做犧牲陽極法 組卷:92引用:6難度:0.6 -
6.下列敘述正確的是( )
A.除去NH4Cl溶液中的FeCl3;可加入氨水調節溶液至適當pH B.離子交換膜在工業上應用廣泛,如氯堿工業中使用陰離子交換膜 C.電解精煉銅時,若陰極析出3.2g銅,則陽極失電子數大于6.02×1022 D.用標準鹽酸滴定未知濃度的NaOH溶液,滴定前酸式滴定管尖嘴有氣泡未排出,滴定后氣泡消失,會造成測定結果偏低 組卷:21引用:2難度:0.6
二、(非選擇題,本題包括4小題,共55分)
-
18.工業上由黃銅礦(主要成分CuFeS2)冶煉銅的主要流程如圖:
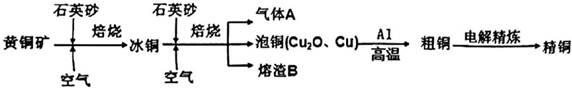
(1)氣體A中的大氣污染物可選用下列試劑中的吸收。
A.氨水
B.稀HNO3
C.濃H2SO4
D.NaOH溶液
(2)為檢驗熔渣中含有的Fe3+,用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加2滴硫氰化鉀溶液,反應的現象為:,反應的離子方程式為:。
(3)由泡銅冶煉粗銅的化學反應方程式為。
(4)若如圖為粗銅的電解精煉。在粗銅的電解過程中,粗銅板應是圖中電極(填圖中的字母);若粗銅中還含有Au、Ag、Fe,它們在電解槽中的存在形式和位置為。
(5)若圖中c、d均為惰性電極,溶液體積為100mL,當c、d兩極生成的氣體均為448mL時,溶液中的H+物質的量濃度為(反應過程中溶液體積變化忽略不計),如果需將溶液恢復至原來的濃度,需加入的試劑為:。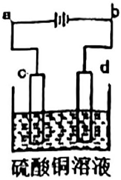 組卷:3引用:1難度:0.5
組卷:3引用:1難度:0.5 -
19.H2S是一種大氣污染物。工業尾氣中含有H2S,會造成嚴重的環境污染;未脫除H2S的煤氣,運輸過程中還會腐蝕管道。
(1)電化學溶解—沉淀法是一種回收利用H2S的新方法,其工藝原理如圖所示。
已知:Zn與強酸、強堿都能反應生成H2;Zn(Ⅱ)在過量的強堿溶液中以[Zn(OH)4]2-形式存在。
①鋅棒連接直流電源的(填“正極”或“負極”)。
②反應器中反應的離子方程式為。
③電解槽中,沒接通電源時已經有H2產生,用離子方程式解釋原因:。
(2)常用碘量法測定煤氣中H2S的含量,其實驗過程如下:
i.將10L煤氣通入盛有100mL鋅氨絡合液的洗氣?中,將其中的H2S全部轉化為ZnS沉淀,過濾;
ii.將帶有沉淀的濾紙加入盛有15mL0.1mol/L碘標準液、200mL水和10mL鹽酸的碘量瓶中,蓋上瓶塞,搖動碘量瓶至瓶內濾紙搖碎,置于暗處反應10min后,用少量水沖洗瓶壁和瓶塞。(已知:ZnS+I2═ZnI2+S)
iii.用0.1mol/LNa2S2O3標準液滴定,待溶溶呈淡黃色時,加入1mL淀粉指示劑,繼續滴定至終點。(已知:2Na2S2O3+I2═Na2S4O6+2NaI)
①i中,將煤氣中的H2S轉化為ZnS的目的是。
②滴定終點的現象是。
③若消耗Na2S2O3標準液的體積為20mL,則煤氣中H2S的含量為mg/L。組卷:7引用:1難度:0.5


