2021-2022學年江蘇省蘇州市八校聯盟高三(上)第二次適應性檢測化學試卷
發布:2024/4/20 14:35:0
一、單項選擇題:本題包括14小題,每小題3分,共計42分。每小題只有一個選項符合題意。
-
1.中華優秀傳統文化博大精深、源遠流長,王翰《涼州詞》中寫道“葡萄美酒夜光杯,欲飲琵琶馬上催…”。夜光杯的主要成分為3MgO?4SiO2?H2O,古代制作琵琶的主要原料為木料或竹料、絲線等,下列說法錯誤的是( )
A.由蠶絲搓紡而成的絲線的主要成分為蛋白質 B.忽略水和酒精之外的其它成分,葡萄美酒的度數越低,則酒的密度越低 C.夜光杯屬硅酸鹽產品,不溶于水,具有耐酸堿侵蝕、抗氧化等優點 D.制作琵琶的竹料放入飽和Na2SiO3溶液中充分浸透后瀝干可起到防火的作用 組卷:145引用:6難度:0.8 -
2.CH3OH、N2H4和(CH3)2NNH2均為常見的燃料,關于這三者的結構與性質,下列說法錯誤的是( )
A.CH3OH的電子式為 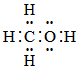
B.N2H4空間結構為平面形 C.CH3OH、N2H4和(CH3)2NNH2都易溶于水 D.CH3OH和(CH3)2NNH2中C、O、N雜化方式均相同 組卷:18引用:1難度:0.7 -
3.AlCl3熔點190℃,沸點182.7℃,在177.8℃升華。某同學利用如下裝置(部分夾持儀器已略)制備無水AlCl3,其中能達到相應實驗目的的是( )
A. 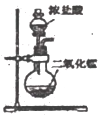
制取氯氣B. 
干燥氯氣C. 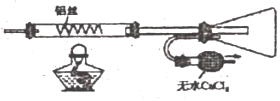
制取并收集AlCl3D. 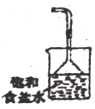
吸收尾氣組卷:8引用:1難度:0.5 -
4.下列有關鈉及其化合物的性質與用途具有對應關系的是( )
A.鈉單質熔點較低,可用于冶煉金屬鈦 B.次氯酸鈉具有強氧化性,可用作環境消毒劑 C.氫氧化鈉具有強堿性,可用作干燥劑 D.碳酸氫鈉受熱易分解,可用于泡沫滅火器 組卷:140引用:8難度:0.6 -
5.W、X、Y、Z為原子序數依次增大的短周期主族元素,Y的原子序數等于W與X的原子序數之和,Z的最外層電子數為K層的一半,W與X可形成原子個數比為2:1的18e-分子。下列說法正確的是( )
A.簡單離子半徑:Z>X>Y B.W與Y能形成含有非極性鍵的化合物 C.X和Y的最簡單氫化物的沸點:X>Y D.由W、X、Y三種元素所組成化合物的水溶液均顯酸性 組卷:756引用:11難度:0.5
二、非選擇題:共4題。共58分。
-
17.[Cu(NH3)x]SO4?yH2O是易溶于水的深藍色晶體,是廣譜殺菌劑。實驗室通過如圖1流程測定其組成。

(1)[Cu(NH3)x]SO4?yH2O中氨的測定堿溶過程是在如圖2裝置中進行的,用滴定方法完成燒杯中氨的測定。
①燒瓶中有黑色固體生成,該黑色固體的化學式為。
②反應停止后還需要進行的操作是。
③實驗完成后需要將倒扣漏斗提出液面,在燒杯上方用蒸餾水對漏斗的內外壁洗滌,原因是。
(2)Cu(NH3)x]SO4?yH2O中銅元素含量的測定(已知:Na2S2O3在pH為8~9穩定,pH<8時會發生歧化;I2+2S2═2I-+S4O2-3)O2-6
①準確稱取樣品Cu(NH3)x]SO4?yH2O0.04624g投入到過量的NaOH溶液中,過濾,把濾渣加入6mol?L-1H2SO4溶液中,攪拌使濾渣充分溶解,向溶解后的溶液中加入2gKI(過量)固體,攪拌,充分反應后,記錄消耗Na2S2O3溶液體積。(須用試劑:Na2CO3溶液、0.1800mol?L-1Na2S2O3、淀粉溶液、蒸餾水)
②若反應消耗Na2S2O3溶液的體積為12.00mL,則樣品中n(Cu2+)=。組卷:97引用:2難度:0.5 -
18.實現碳中和成為各國科學家的研究重點,將二氧化碳轉化為綠色液體燃料(如甲醇)是一個重要方向。通過甲醇合成實現碳捕獲,再在需要能量時進行甲醇水蒸氣重整制備氫氣,實現二氧化碳的閉路循環和氫能的儲存。
I.甲醇的制備:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
該反應一般認為通過如下步驟來實現:
①CO2(g)+H2(g)═CO(g)+H2O(g)△H1=+41kJ?mol-1
②CO(g)+2H2(g)═CH3OH(g)△H2=-90kJ?mol-1
(1)CH3OH的生產速率主要由反應①決定(決速步),下列示意圖中能體現上述反應能量變化的是(填標號)。
A.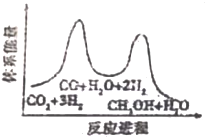 B.
B.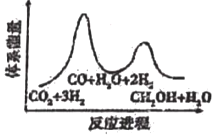
C.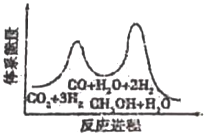 D.
D.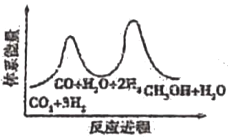
Ⅱ.甲醇、水蒸氣催化重整制氫(SRM),主要制氫過程如圖1所示。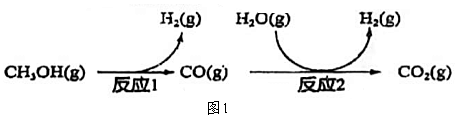
(2)將CH3OH(g)、H2O(g)、O2(g)按一定比例作為原料氣通入容器中發生SRM,原料進氣比對反應1:CH3OH(g)?CO(g)+2H2(g)的選擇性(某產物的選擇性越大,則其含量越多)的影響較為復雜,其關系如圖2。當=0.2時,CH3OH與O2發生的主要反應為n(O2)n(CH3OH)。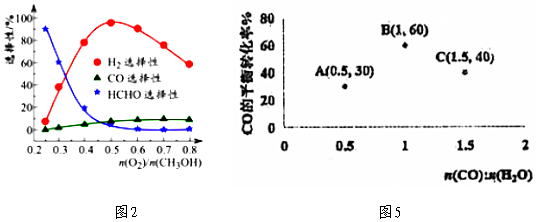
(3)SRM過程中得到了少量的副產物甲酸甲酯,選擇一種活性較高的催化劑CuZnAl(組成里含CuO、ZnO、Al2O3的物質的量之比為1:1:1),并在該1mol催化劑中分別加入1mol、2mol、3molMgO對其進行改性(MgO不參與催化作用),分別可得CuZnAlMg1、CuZnAlMg2、CuZnAlMg3。改性后狀態如表1所示,部分反應過程及不同催化劑對甲酸甲酯含量的影響如圖3及圖4所示。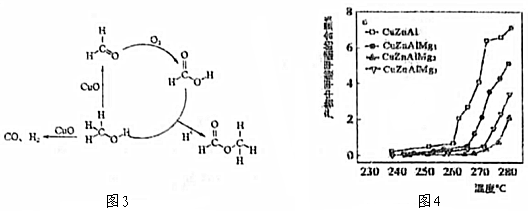
①甲醇生成副產物甲酸甲酯的過程可描述為孔體積/(cm3/g) 比表面積/(m2/g) 孔徑/nm CuZnAl 0.23 33.58 22.77 CuZnAlMg1 0.38 56.63 27.06 CuZnAlMg2 0.50 69.76 28.97 CuZnAlMg3 0.36 61.85 23.27 。
②選用CuZnAlMg2為催化劑可以減少副產物甲酸甲酯的含量,請解釋其原因。
(4)在對反應2:CO(g)+H2O(g)?H2(g)+CO2(g)△H<0的單獨研究中,發現在進氣比不同時,測得相應的CO的平衡轉化率如圖5(各點對應溫度可能不同)。圖5中B、C兩點對應的反應溫度分別為TB和TC,其中相對低溫的是n(CO)n(H2O)。(填TB或TC)。
(5)實驗發現,其他條件不變,向反應2的平衡體系中投入一定量納米CaO可明顯提高H2的體積分數,原因是。組卷:15引用:1難度:0.7


