2021年湖北省武漢市漢陽一中高考化學仿真模擬試卷(五)
發布:2024/11/12 13:30:2
一.選擇題:本題共15小題,每小題3分,共45分。在每小題給出的四個選項中,只有一項符合題目要求。
-
1.“葡萄美酒夜光杯,欲飲琵琶馬上催”渲染了古代戰士出征的悲壯場面。下列說法正確的是( )
A.葡萄酒度數越高密度越大 B.夜光杯的主要成分氟化鈣能溶于酒精中 C.葡萄釀制葡萄酒過程中有氣體生成 D.古代琵琶弦用牛筋制成,牛筋不屬于高分子化合物 組卷:42引用:1難度:0.7 -
2.下列化學用語使用正確的是( )
A.聚丙烯的鍵線式 
B.羥基的電子式 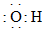
C.亞鐵離子結構示意圖 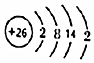
D.[AlCl4]-的球棍模型: 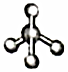 組卷:11引用:2難度:0.6
組卷:11引用:2難度:0.6 -
 3.某品牌牙膏的成分含水、丙三醇、二氧化硅、苯甲酸鈉、十二烷基硫酸鈉和氟化鈉等。已知:牙釉質中含有羥基磷酸鈣[Ca5(PO4)3OH],是牙齒的保護層。在牙齒表面存在平衡:Ca5(PO4)3OH(s)?5Ca2+(aq)+3PO43-(aq)+OH-(aq);Ksp[Ca5(PO)3OH]>Ksp[Ca5(PO)3F]。下列說法不正確的是( )
3.某品牌牙膏的成分含水、丙三醇、二氧化硅、苯甲酸鈉、十二烷基硫酸鈉和氟化鈉等。已知:牙釉質中含有羥基磷酸鈣[Ca5(PO4)3OH],是牙齒的保護層。在牙齒表面存在平衡:Ca5(PO4)3OH(s)?5Ca2+(aq)+3PO43-(aq)+OH-(aq);Ksp[Ca5(PO)3OH]>Ksp[Ca5(PO)3F]。下列說法不正確的是( )A.若使牙膏呈弱酸性,更有利于保護牙釉質 B.丙三醇的俗稱是甘油 C.SiO2是摩擦劑,有助于去除牙齒表面的污垢 D.NaF能將Ca5(PO4)3OH轉化為更難溶的Ca5(PO4)3F,減少齲齒的發生 組卷:88引用:2難度:0.5 -
4.NA為阿伏加德羅常數的值。下列說法正確的是( )
A.5.4g Al分別與含溶質0.2mol的NaOH溶液、鹽酸反應,生成H2分子數均為0.3NA B.將1mol NH4NO3溶于稀氨水配成1L溶液,所得溶液呈中性,則溶液中NH4+數目為NA C.電解CuSO4溶液后,要加入9.8g Cu(OH)2恢復電解前狀態,則電解中轉移電子數為0.2NA D.合成氨反應中,當2NA個H-H斷裂,同時有NA個N-H斷裂,則反應達到最大限度 組卷:30引用:2難度:0.7 -
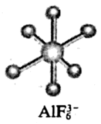 5.F-與Al3+可以形成非常穩定的AlF63-(結構見圖),試劑乙二胺四乙酸(簡稱EDTA)能與Al3+和Zn2+發生配位反應。現欲用EDTA試劑來滴定某溶液中Zn2+(只含Al3+雜質),可加入NH4F溶液,在pH=5.5左右以二甲酚橙作指示劑可以滴定測量Zn2+的濃度。下列說法不正確的是( )
5.F-與Al3+可以形成非常穩定的AlF63-(結構見圖),試劑乙二胺四乙酸(簡稱EDTA)能與Al3+和Zn2+發生配位反應。現欲用EDTA試劑來滴定某溶液中Zn2+(只含Al3+雜質),可加入NH4F溶液,在pH=5.5左右以二甲酚橙作指示劑可以滴定測量Zn2+的濃度。下列說法不正確的是( )A.AlF63-離子構型為正八面體 B.Al(OH)3不能溶于濃的氫氟酸溶液 C.F-與Al3+發生反應方程式:Al3++6F-?AlF63-,該反應平衡常數非常大 D.NH4F的作用是作為遮掩劑,利用F-和Al3+形成AlF63-,以防止Al3+和EDTA試劑發生配位反應 組卷:61引用:2難度:0.7 -
6.下列反應的方程式正確的是( )
A.向Ca(ClO)2溶液中通入過量CO2制次氯酸:2ClO-+H2O+CO2═2HClO+ CO2-3B.[Ag(NH3)2]OH與較濃鹽酸反應生成AgCl:[Ag(NH3)2]++OH-+3H++Cl-═AgCl↓+2 +H2ONH+4C.硫酸銨與亞硝酸鈉溶液共熱:(NH4)2SO4+2NaNO2═Na2SO4+2NH3+NO2+NO+H2O D.向酸化KMnO4溶液中通入SO2:2 +5SO2+4OH-═2Mn2++5MnO-4+2H2OSO2-4組卷:12引用:3難度:0.6
二、非選擇題:本題共4小題,共55分。
-
18.防火材料聚碳酸酯(PC)的結構簡式為:
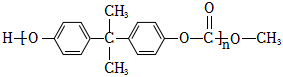 ,其合成路線如圖。
,其合成路線如圖。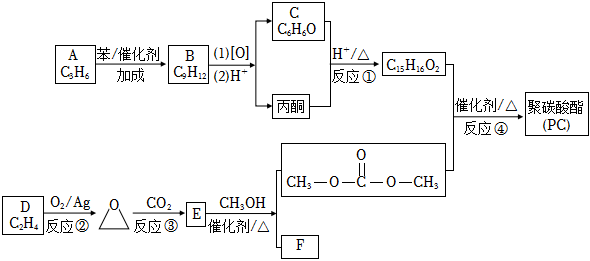
已知:
ⅰ.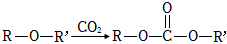
ⅱ. (R、R′、R1、R2、R3為烴基)
(R、R′、R1、R2、R3為烴基)
(1)A的名稱為。
(2)B的結構簡式為。
(3)C的溶液和濃溴水反應的方程式為。
(4)反應①的化學方程式為。
(5)下列說法不正確的是。
a.分子式為C7H8O,且與C互為同系物的同分異構體有4種
b.反應②的原子利用率為100%
c.反應③為取代反應,生成E的結構簡式為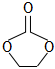
(6)反應④的化學方程式為。
(7)查閱資料:利托那韋是治療新冠肺炎的藥物,制備該藥物需要的一種中間體X的結構簡式為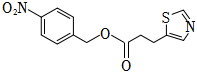 。
。
結合題中已知信息完成下列合成路線,寫出有機物甲和乙的結構簡式。
①有機物甲的結構簡式為。
②有機物乙的結構簡式為。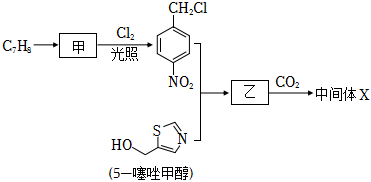 組卷:52引用:3難度:0.5
組卷:52引用:3難度:0.5 -
19.亞硝酰硫酸[M(NOSO4H)=127g?mol-1]主要用于分散染料重氮反應中取代亞硝酸鈉,從而降低成本,提高產品質量。實驗室用如圖1裝置(夾持裝置略)制備少量NOSO4H,并測定產品的純度。已知:NOSO4H遇水分解,但溶于濃硫酸而不分解。
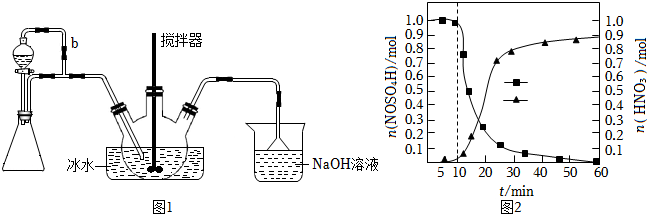
(1)裝置A制取SO2,則A中反應的化學方程式為,導管b的作用是。
(2)SO2與裝置B中盛有的濃硫酸和濃硝酸的混合液在維持體系溫度不得高于20℃的條件下,反應制得NOSO4H.反應過程中,亞硝酰硫酸和硝酸的物質的量隨時間的變化如圖2所示。
①裝置B中發生反應的化學反應方程式為。
②反應進行到10min后,反應速度明顯加快,其可能的原因是。
③反應過程中,硝酸減少的物質的量大于NOSO4H生成的物質的量的可能原因是。
(3)裝置C的主要作用是。
(4)該實驗裝置存在可能導致NOSO4H產量降低的缺陷是。
(5)測定亞硝酰硫酸NOSO4H的純度
準確稱取1.500g產品放入250mL的碘量瓶中,加入0.1000mol?L-1、60.00mL的KMnO4標準溶液和10mL 25%H2SO4溶液,然后搖勻。用0.2500mol?L-1草酸鈉標準溶液滴定,消耗草酸鈉溶液的體積為20.00mL。
已知:2KMnO4+5NOSO4H+2H2O═K2SO4+2MnSO4+5HNO3+2H2SO4
2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O
達到滴定終點時的現象為,亞硝酰硫酸的純度為。(精確到0.1%)組卷:24引用:4難度:0.6


