24.閱讀下面科普短文。
我們的胃液呈酸性,是因為胃腺壁細胞能分泌出鹽酸。胃酸在人體的消化吸收中發揮著重要作用,比如為胃蛋白酶提供適宜的酸性環境,分解食物中的結締組織和肌纖維。使其易于被消化吸收。
你知道嗎?深受人們喜愛的早餐食品燕麥中常添加顆粒極小的鐵粉,它既可以作為雙吸劑(起到干燥和減緩食品變質的作用),還可以作為補鐵劑。要把鐵粉變為人體需要的、能吸收的營養元素,就離不開胃酸的幫助。
健康人胃液的pH在0.9~1.5,胃液的pH不僅影響人的消化吸收功能,還對伴隨食物進入人胃內的各類病菌的繁殖有影響。某醫院對99位胃潰瘍和十二指腸潰瘍等患者胃液的pH及胃液中病菌進行了檢測,結果如下表所示。
表——人體胃液pH情況分析
| 分組 |
胃液的pH |
受檢患者人數 |
胃液中檢出病菌的人數及比例 |
| A |
≤2.0 |
7 |
0(0.0%) |
| B |
2.0-4.0 |
13 |
3(23.1%) |
| C |
4.0-6.0 |
26 |
17(65.4%) |
| D |
>6.0 |
53 |
45(84.9%) |
胃酸過多會對胃黏膜產生侵蝕作用,并使人感覺反酸或胃灼熱。治療胃酸過多的藥主要有兩大類:一是抑酸藥,能抑制胃酸分泌,但本身不能和胃酸反應;二是抗酸藥,能直接與胃酸反應。常服用的抗酸藥的藥物有碳酸氫鈉、氫氧化鋁、氧化鎂、氫氧化鎂和碳酸鈣等。
胃潰瘍患者若服用不合適的抗酸藥,會因胃內氣體壓力增大而引起胃穿孔。患者如長期使用抗酸藥,很可能刺激胃酸分泌過多。因此,應遵醫囑合理使用抗酸類和抑酸類藥物。
(一)依據文章內容回答下列問題。
(1)碳酸氫鈉、氫氧化鋁、氧化鎂、氫氯化鎂和碳酸鈣,屬于氧化物的是
(填化學式)。
(2)鐵粉可以減緩食物變質,是因為鐵可以和空氣中的
反應。
(3)燕麥中的鐵粉遇到胃酸發生的化學反應,化學方程式是
。
(4)分析表格數據,可以得出胃液pH越
(填“大”或“小”)越有利于病菌生存。
(5)下列說法正確的是
(填字母序號)。
A.治療胃酸過多的藥物都能與鹽酸反應
B.部分燕麥片中含有極少量的鐵單質
C.氫氧化鋁、氫氧化鎂可以治療各種胃酸過多
D.選用碳酸鈣治療胃酸過多,同時還可以補鈣
(二)胃酸過多會引起不適,不同病癥需要服用不同的抗酸藥。實驗小組同學對抗酸藥選擇進行探究。
【查閱資料】
1.抗酸藥主要利用有效成分與胃液中的過量鹽酸反應,藥品用量一般為1~2片(約=0.5g~1g)。
2.氧化鎂和氧化鐵均屬于金屬氧化物,與鹽酸反應的原理相似。
3.胃蛋白酶是胃中唯一的消化性蛋白酶,當pH為3~5時活性較好,當pH超過6時,因變性而失去活性。
4.理想抗酸藥應具備起效快速,避免產生氣體刺激潰瘍面等特點。
【進行實驗】
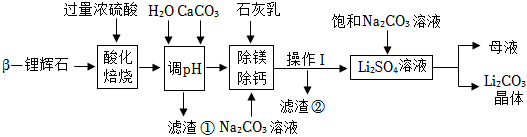
Ⅰ.是否引起胃內壓強的變化
錐形瓶中模擬胃酸過多的環境。將氣球中的抗酸藥加入錐形瓶中。
 |
1-1 |
氫氧化鋁片 |
氣球無明顯變化 |
| 1-2 |
碳酸氫鈉片 |
氣球明顯膨脹 |
| 1-3 |
鋁碳酸鎂咀嚼片 |
氣球無明顯變化 |
| 1-4 |
氧化鎂粉末 |
氣球無明顯變化 |
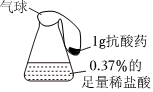
Ⅱ.是否引起胃內溫度和pH的變化
利用圖1進行實驗。向4個燒瓶中分別加入抗酸藥,打開恒壓滴液漏斗,滴加0.37%的足量稀鹽酸。傳感器測得的相關結果見圖2、3、4。
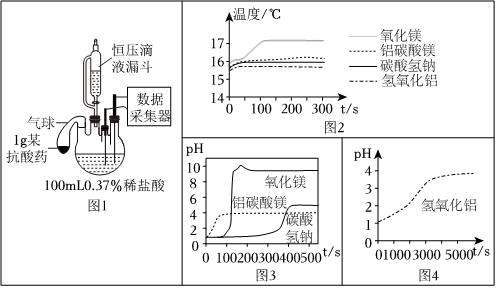
(6)碳酸氫鈉的俗稱是
。
【解釋與結論】
(7)Ⅰ中,實驗1-1發生反應的化學方程式為
。
(8)藥品用量在1~2片內,針對“嚴重胃潰瘍患者”不建議選用的抗酸藥及理由是
。
(9)下列關于氧化鎂粉末、氫氧化鋁片分別與鹽酸反應的敘述正確的是
(填序號)。
A.氧化鎂粉末的反應會引起溫度上升
B.反應后溶液均顯堿性
C.氫氧化鋁片的反應更快
D.均有水生成
(10)由上述實驗可知,鋁碳酸鎂咀嚼片的優勢有
。
【反思與評價】
(11)查閱資料發現Ⅰ中實驗1-3無明顯現象是與物質的用量有關。小明同學設計實驗證明了鋁碳酸鎂咀嚼片中含有碳酸根離子,實驗操作和現象:取6片鋁碳酸鎂咀嚼片于試管中,
。