2021-2022學(xué)年貴州省畢節(jié)市金沙一中高二(上)期中化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題:本題共16小題,每小題3分,共48分。在每小題給出的四個(gè)選項(xiàng)中,只有一項(xiàng)符合題目要求。
-
1.某同學(xué)設(shè)計(jì)如圖所示實(shí)驗(yàn),探究反應(yīng)中的能量變化.下列判斷正確的是( )
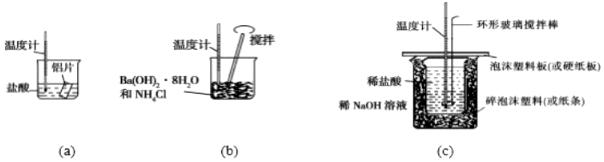
A.(a)、(b)、(c)涉及的反應(yīng)都是放熱反應(yīng) B.將實(shí)驗(yàn)(a)中的等質(zhì)量的鋁片換成鋁粉后,釋放出的總熱量有所增加 C.實(shí)驗(yàn)(c)中,將環(huán)形玻璃攪拌棒改為鐵質(zhì)攪拌棒對(duì)實(shí)驗(yàn)結(jié)果沒(méi)有影響 D.實(shí)驗(yàn)(c)中,若用NaOH固體代替NaOH溶液,測(cè)出的△H的數(shù)值偏大 組卷:16引用:4難度:0.6 -
2.下列熱化學(xué)方程式書寫正確的是( )
A.2SO2+O2 2SO3△H=-196.6 kJ?mol-1催化劑加熱B.H2(g)+ O2(g)═H2O(l)△H=-285.8 kJ?mol-112C.2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ D.C(s)+O2(g)═CO2(g)△H=+393.5 kJ?mol-1 組卷:124引用:7難度:0.8 -
3.有關(guān)熱化學(xué)方程式書寫與對(duì)應(yīng)表述均正確的是( )
A.稀硫酸與0.1mol?L-1NaOH溶液反應(yīng):H+(aq)+OH-(aq)═H2O(l)△H=+57.3kJ?mol-1 B.在101kPa下H2(g)的燃燒熱為285.8kJ?mol-1,則水分解的熱化學(xué)方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.8kJ?mol-1 C.已知CH3OH的燃燒熱為726.8kJ?mol-1,則有CH3OH(l)+ O2(g)═CO2(g)+2H2O(g)△H=-726.8kJ?mol-132D.已知9.6g硫粉與11.2g鐵粉混合加熱生成17.6gFeS時(shí)放出19.12kJ熱量,則Fe(s)+S(s)═FeS(s)△H=-95.6kJ?mol-1 組卷:333引用:16難度:0.8 -
4.下列示意圖表示正確的是( )
A. 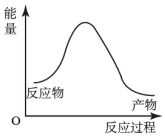
如圖表示Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=+26.7kJ?mol-1反應(yīng)的能量變化B. 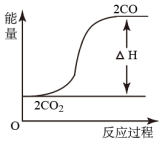
如圖表示碳的燃燒熱C. 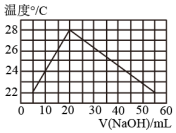 如
如
圖表示實(shí)驗(yàn)的環(huán)境溫度為20℃,將物質(zhì)的量濃度相等、體積分別為V1、V2的H2SO4、NaOH溶液混合,混合液的最高溫度隨V(NaOH)的變化(已知V1+V2=60mL)D. 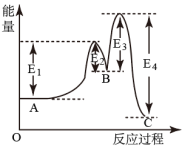
已知穩(wěn)定性順序:B<A<C,某反應(yīng)由兩步反應(yīng)A→B→C構(gòu)成,反應(yīng)過(guò)程中的能量變化曲線如圖組卷:57引用:12難度:0.5 -
5.有關(guān)鍵能數(shù)據(jù)如表晶體硅在氧氣中燃燒的熱化學(xué)方程式:Si(s)+O2(g)═SiO2(s)△H=-989.2kJ?mol-1,則表中X的值為( )
化學(xué)鍵 Si-O O=O Si-Si 鍵能kJ?mol-1 X 498.8 176 A.423.3 B.460 C.920 D.1165.2 組卷:52引用:6難度:0.1 -
6.已知4NH3(g)+5O2(g)═4NO(g)+6H2O(g),若反應(yīng)速率分別用v(NH3)、v(O2)、v(NO)、v(H2O)表示,則下列關(guān)系正確的是( )
A.4v(NH3)=5v(O2) B.5v(O2)=6v(H2O) C.2v(NH3)=3v(H2O) D.4v(O2)=5v(NO) 組卷:157引用:25難度:0.9 -
7.下列表格中的各種情況,可以用下面對(duì)應(yīng)選項(xiàng)中的圖象曲線表示的是( )
反應(yīng) 甲 乙 A 外形、大小相近的金屬和水反應(yīng) Na K B 4mL0.01mol?L-1的KMnO4溶液,分別和不同濃度的H2C2O4(草酸)溶液2mL反應(yīng) 0.1mol?L-1的H2C2O4溶液 0.2mol?L-1的H2C2O4溶液 C 5mL0.1mol?L-1Na2S2O3溶液和5mL0.1mol?L-1H2SO4溶液反應(yīng) 熱水 冷水 D 5mL4%的過(guò)氧化氫溶液分解放出O2 無(wú)MnO2粉末 加MnO2粉末 A. 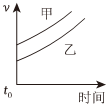
B. 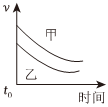
C. 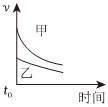
D. 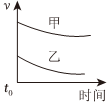 組卷:50引用:14難度:0.5
組卷:50引用:14難度:0.5
二、填空題(共6小題,每小題12分,滿分57分)
-
 21.50 mL0.50 mol?L-1鹽酸與50 mL 0.55 mol?L-1 NaOH溶液在如圖所示的裝置中進(jìn)行中和反應(yīng)。通過(guò)測(cè)定反應(yīng)過(guò)程中所放出的熱量可計(jì)算中和熱。回答下列問(wèn)題:
21.50 mL0.50 mol?L-1鹽酸與50 mL 0.55 mol?L-1 NaOH溶液在如圖所示的裝置中進(jìn)行中和反應(yīng)。通過(guò)測(cè)定反應(yīng)過(guò)程中所放出的熱量可計(jì)算中和熱。回答下列問(wèn)題:
(1)從實(shí)驗(yàn)裝置上看,圖中尚缺少的一種玻璃儀器是。
(2)燒杯間填滿碎紙條的作用是。
(3)大燒杯上如不蓋硬紙板,求得的中和熱數(shù)值(填“偏大”、“偏小”或“無(wú)影響”)。
(4)該實(shí)驗(yàn)常用0.50mol?L-1HCl和0.55mol?L-1 NaOH溶液各50mL進(jìn)行實(shí)驗(yàn),其中NaOH溶液濃度大于鹽酸濃度的作用是,當(dāng)室溫低于10℃時(shí)進(jìn)行實(shí)驗(yàn),對(duì)實(shí)驗(yàn)結(jié)果會(huì)造成較大的誤差,其原因是。
(5)實(shí)驗(yàn)中改用60mL0.50mol?L-1鹽酸與50mL0.50mol?L-1NaOH溶液進(jìn)行反應(yīng),與上述實(shí)驗(yàn)相比,所求得的中和熱(填“相等”或“不相等”),簡(jiǎn)述理由:。
(6)用相同濃度和體積的氨水代替NaOH溶液進(jìn)行上述實(shí)驗(yàn),測(cè)得的中和熱ΔH將(填“偏大”、“偏小”或“無(wú)影響”)。組卷:26引用:1難度:0.7 -
22.某化學(xué)小組為了研究外界條件對(duì)化學(xué)反應(yīng)速率的影響,進(jìn)行了如下實(shí)驗(yàn):
[實(shí)驗(yàn)內(nèi)容及記錄](méi)
室溫下,試管中所加試劑及其用量/mL
請(qǐng)回答:實(shí)驗(yàn)編號(hào) 室溫下,試管中所加試劑及其用量/mL 室溫下溶液顏色退至無(wú)色所需時(shí)間/min 0.6mol/L H2C2O4溶液 H2O 3mol/L稀硫酸 0.05 mol/L KMnO4溶液 1 3.0 2.0 2.0 3.0 1.5 2 2.0 3.0 2.0 3.0 2.7 3 1.0 4.0 2.0 3.0 3.9
(1)該實(shí)驗(yàn)的反應(yīng)原理是(用離子方程式表示)。
(2)根據(jù)上表中的實(shí)驗(yàn)數(shù)據(jù),可以得到的結(jié)論是。
(3)利用實(shí)驗(yàn)1中數(shù)據(jù)計(jì)算,若用KMnO4的濃度變化表示的反應(yīng)速率為:v(KMnO4)=。
(4)該小組同學(xué)根據(jù)經(jīng)驗(yàn)繪制了n(Mn2+)隨時(shí)間變化趨勢(shì)的示意圖,如圖1所示。但有同學(xué)查間已有的實(shí)驗(yàn)資料發(fā)現(xiàn),該實(shí)驗(yàn)過(guò)程中n(Mn2+)隨時(shí)間變化的趨勢(shì)應(yīng)如圖2所示。該小組同學(xué)根據(jù)圖2所示信息提出了新的假設(shè),并繼續(xù)進(jìn)行實(shí)驗(yàn)探究。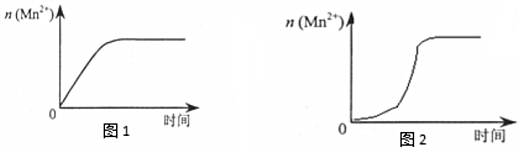
①該小組同學(xué)提出的假設(shè)是。
②請(qǐng)你幫助該小組同學(xué)光成表中的實(shí)驗(yàn)方案4,表中空白處應(yīng)加入的固體是。
③若這小組同學(xué)提出的假設(shè)成立,應(yīng)觀察的現(xiàn)象是實(shí)驗(yàn)編號(hào) 室溫下,試管中所加試劑及其用量/mL 再向試管中加入少量固體 室溫下溶液顏色退至無(wú)色所需時(shí)間/min 0.6mol/L H2C2O4溶液 H2O 3mol/L 稀硫酸 0.05mol/L KMnO4溶液 4 3.0 2.0 2.0 3.0 t 。組卷:31引用:3難度:0.3


