2022-2023學年北京師大附屬實驗中學高一(上)期末化學試卷
發布:2024/4/20 14:35:0
一、本部分共25題,每題2分,共50分。在每題列出的四個選項中,選出最符合題目要求的一項。
-
1.合金的應用促進了人類社會的發展。下列不屬于合金的是( )
A.青銅面具 B.鋁合金滑雪杖 C.不銹鋼鍋 D.塑料管材 



A.A B.B C.C D.D 組卷:66引用:4難度:0.8 -
2.下列化合物中,含共價鍵的是( )
A.CO2 B.Na2O C.KCl D.MgCl2 組卷:63引用:4難度:0.5 -
3.下列關于物質用途的說法不合理的是( )
A.ClO2用于自來水消毒 B.Fe3O4用作紅色顏料 C.碳酸氫鈉可用于焙制糕點 D.FeCl3刻蝕電路板 組卷:6引用:1難度:0.6 -
4.下列儀器不能用于加熱的是( )
A. 
B. 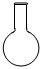
C. 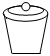
D. 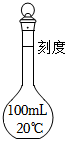 組卷:118引用:14難度:0.7
組卷:118引用:14難度:0.7 -
5.下列物質與Cl2反應,能發出蒼白色火焰的是( )
A.H2 B.Na C.Fe D.Cu 組卷:409引用:12難度:0.8 -
6.四種基本反應類型中,一定是氧化還原反應的是( )
A.化合反應 B.分解反應 C.置換反應 D.復分解反應 組卷:86引用:28難度:0.9 -
7.下列關于物質的分類的說法中,不正確的是( )
A.H2CO3屬于酸 B.Na2CO3屬于堿 C.SO3屬于酸性氧化物 D.液氯屬于純凈物 組卷:103引用:4難度:0.9 -
8.下列物質中,屬于電解質的是( )
A.Cu B.稀硫酸 C.NaCl D.C2H5OH 組卷:40引用:4難度:0.9 -
9.下列粒子不具有還原性的是( )
A.Na B.Fe2+ C.I- D.H+ 組卷:129引用:7難度:0.7 -
10.下列電離方程式書寫不正確的是( )
A.HNO3═H++NO3- B.Ba(OH)2═Ba2++OH- C.FeCl3═Fe3++3Cl- D.NH4NO3═NH4++NO3- 組卷:53引用:2難度:0.7 -
11.下列物質放置在空氣中,因發生氧化還原反應而變質的是( )
A.Fe(OH)2 B.Ca(OH)2 C.Na2O D.Na2CO3 組卷:8引用:1難度:0.8
二、解答題(共9小題,滿分50分)
-
33.硫酸渣是硫酸生產過程中產生的固體廢料,主要化學成分有Fe2O3、FeO、SiO2等。含氯廢氣是海綿鈦冶煉過程中產生的Cl2和HCl的混合氣。可利用兩種廢料來制備聚合氯化鐵[Fe2(OH)nCl6-n]m。實驗室模擬該生產過程如圖所示:
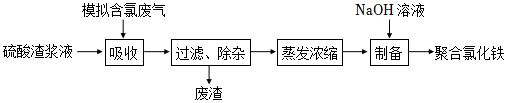
已知:SiO2是難溶于水的酸性氧化物。
(1)吸收過程中硫酸渣漿液中的FeO全部轉化為Fe3+,寫出反應的離子方程式、。
(2)過濾除雜后所得廢渣的主要成分是。
(3)硫酸渣漿液中水與硫酸渣的質量比稱為液固比。其他條件相同時,在相同時間內不同液固比對鐵元素利用率的影響如圖所示。由圖可知液固比為3:1和5:1時鐵元素利用率均較高,而實際工業生產中選擇液固比為3:1,從后續處理能耗的角度分析,原因是。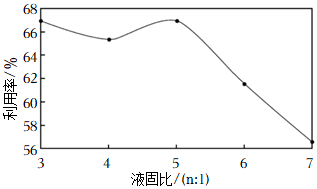
(4)制備時,需在劇烈攪拌下,向所得高濃度的FeCl3溶液中緩慢滴加NaOH溶液至預定的比例。
①補全反應的化學方程式:FeCl3+NaOH═[Fe2(OH)nCl6-n]m+NaCl。
②上述制備過程中,不能快速滴加NaOH溶液的原因是。
(5)測定聚合氯化鐵液體產品中鐵元素的質量分數。
取ag樣品加水稀釋,在不斷攪拌下加入NaOH溶液調至pH=3.5,此時鐵元素全部轉化為Fe(OH)3沉淀,過濾、洗滌并灼燒所得沉淀,最終得到bg紅棕色固體。則產品中鐵元素的質量分數為。組卷:76引用:3難度:0.5 -
34.某小組探究S單質與NaOH溶液加熱后得到的產物。向5mLNaOH溶液中加入少量硫粉,加熱至固體全部溶解,冷卻后,得到淡黃色溶液A(pH=12)。
【資料】Na2S溶液無色,S2-能與H+反應生成H2S(臭雞蛋氣味氣體),能與Cu2+反應生成CuS(黑色固體)。Na2Sx溶液呈黃色,Sx2-能與H+反應生成S和H2S,能與Cu2+反應生成S和CuS。S2-和Sx2-均不能使品紅褪色,SO32-或高濃度OH-能使品紅褪色。
(1)如圖所示,進行實驗Ⅰ和Ⅱ,證實了產物中含SO32-。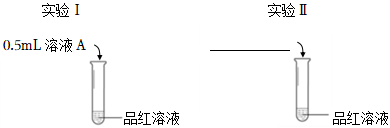
①補全實驗Ⅱ的方案(在橫線上填寫試劑)。
②證實產物中含SO32-的現象是。
(2)依據產物中含SO32-,甲同學認為產物還應該有S2-,請依據氧化還原反應的規律進行解釋:。
(3)甲同學推測溶液A中可能還含有SO42-,因為SO32-在加熱過程中可能與空氣中氧氣反應。針對此觀點繼續實驗Ⅲ:取溶液A于試管中,加入足量稀鹽酸,立即出現淡黃色渾濁,同時產生臭雞蛋氣味的氣體,離心沉淀(固液分離),得到無色溶液B和淡黃色固體。取無色溶液B,(填操作和現象),證實溶液A中存在SO42-。
(4)甲同學根據溶液A呈淡黃色猜想其中還存在Na2Sx,并認為實驗Ⅲ中的現象可做為證據。但乙同學認為實驗Ⅲ中的現象不能說明,理由是。
(5)繼續進行實驗Ⅳ,驗證了溶液A中存在Na2Sx。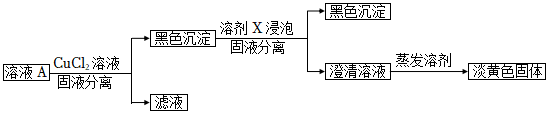
①溶劑X是(填化學式)。
②證明溶液中含Sx2-的實驗證據是。
(6)進一步實驗,得到結論:硫單質在堿性條件下歧化反應的產物主要為S2-和SO32-,溶液中還會生成少量的Sx2-、S2O32-和SO42-。組卷:77引用:1難度:0.6


