2021-2022學年廣東省惠州一中高二(上)期中化學試卷
發布:2024/8/6 8:0:9
一、選擇題:(本題共16小題,共54分。1-10小題,每小題3分;11-16小題,每小題3分。每小題只有一個選項符合題目要求。)
-
1.下列物質的水溶液能導電,但屬于非電解質的是( )
A.CH3COOH B.Cl2 C.SO3 D.NH4HCO3 組卷:71引用:7難度:0.9 -
2.化學與環境密切相關,下列有關說法正確的是( )
A.CO2屬于大氣污染物 B.酸雨是pH小于7的雨水 C.CO2、NO2或SO2都會導致酸雨的形成 D.大氣中CO2含量的增加會導致溫室效應加劇 組卷:619引用:28難度:0.9 -
3.下列物質性質和應用都正確且有對應關系的是( )
性質 應用 A 濃硫酸有強吸水性 可用作干燥Cl2、HCl氣體 B SiO2熔點高、硬度小 可用作光纖 C SO2具有漂白性 可使紫色石蕊試液褪為無色 D 濃硝酸具有強氧化性 和甲苯發生取代反應制備TNT炸藥(三硝基甲苯) A.A B.B C.C D.D 組卷:2引用:2難度:0.6 -
4.某化學反應的能量變化如圖所示,下列有關敘述正確的是( )
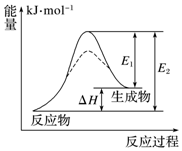
A.該反應為放熱反應 B.加入催化劑,可同時降低E1、E2 C.該反應的反應熱△H=(E1-E2) kJ?mol-1 D.E2可表示形成新的化學鍵所釋放的能量 組卷:44引用:4難度:0.6 -
5.反應4A(s)+2B(g)?2C(g)+D(g)從正向開始,經過2s后B的濃度減少了0.04mol?L-1。下列說法正確的是( )
A.用A表示的反應速率是0.04mol?L-1?s-1 B.在這2s內用B和C表示的反應速率的值是相同的 C.在2s末時的反應速率,用反應物B來表示是0.02mol?L-1?s-1 D.2s后,D的物質的量為0.02mol 組卷:123引用:2難度:0.8 -
6.下列事實中,能說明MOH是弱堿的是( )
A.MOH溶液的導電能力比NaOH溶液弱 B.0.1mol?L-1MOH溶液可以使酚酞溶液變紅 C.常溫下,0.1mol?L-1MOH溶液中c(OH-)<0.1mol?L-1 D.等體積的0.1mol?L-1MOH溶液與0.1mol?L-1鹽酸恰好完全反應 組卷:31引用:4難度:0.5
二、綜合題:本題共3小題,共46分。
-
 18.探究化學反應的快慢和限度具有十分重要的意義。
18.探究化學反應的快慢和限度具有十分重要的意義。
Ⅰ.某實驗小組欲通過用酸性KMnO4和H2C2O4(草酸)反應測定單位時間內生成CO2的速率研究影響反應速率的因素,設計實驗方案如下(KMnO4溶液已酸化),實驗裝置如圖甲所示:
(1)上述反應的離子方程式為:實驗序號 A溶液 B溶液 ① 20mL0.01mol?L-1H2C2O4溶液 30mL0.01mol?L-1KMnO4溶液 ② 20mL0.02mol?L-1H2C2O4溶液 30mL0.01mol?L-1KMnO4溶液 ,該實驗是探究對反應速率的影響。
(2)若實驗①在2min末收集了4.48mLCO2(標準狀況下),則在2min末,c()=MnO-4mol/L(假設混合溶液的體積為50mL,反應前后體積變化忽略不計)。
(3)小組同學發現反應速率變化如圖乙,其中t1~t2時間內速率變快的主要原因可能是①該反應放熱;②。
Ⅱ.溶液中存在平衡:Cr2(橙色)+H2O?2O2-7(黃色)+2H+,該溶液具有強氧化性,其還原產物Cr3+在水溶液中呈綠色或藍綠色。用溶液進行下列實驗:CrO2-4
(4)向K2Cr2O7溶液中加入30%NaOH溶液,溶液呈色;向K2Cr2O7溶液中逐滴加入Ba(NO3)2溶液(已知BaCrO4為黃色沉淀),則平衡向著方向移動,溶液顏色變化為。
(5)對比實驗②和④可得出的結論是。組卷:7引用:3難度:0.6 -
19.氮元素是生命體核酸與蛋白質必不可少的組成元素,氮及其化合物在國民經濟中占有重要地位。

(1)氨催化氧化制得硝酸的同時,排放的氮氧化物也是環境的主要污染物之一。
已知:N2(g)+O2(g)═2NO(g)△H1=+180.5kJ?mol-1
C(s)+O2(g)═CO2(g)△H2=-393.5kJ?mol-1
2C(s)+O2(g)═2CO(g)△H3=-221kJ?mol-1
則反應2CO(g)+2NO(g)═N2(g)+2CO2(g)△H4=。
(2)在容積均為2L的三個恒容密閉容器中分別通入1molCO和1molNO,發生反應2CO(g)+2NO(g)═N2(g)+2CO2(g),a、b、c三組實驗的反應溫度分別記為Ta、Tb、Tc。恒溫恒容條件下反應各體系壓強的變化曲線如圖1所示。
①三組實驗對應溫度的大小關系是(用Ta、Tb、Tc表示),0~20min內,實驗b中v(CO2)=mol?L-1?min-1。
②實驗a條件下,反應的平衡常數K=L?mol-1。
(3)工業用鉑絲網作催化劑,溫度控制在780~840℃,將NH3轉化為NO,反應方程式為4NH3(g)+5O2(g)?4NO(g)+6H2O(g)。回答下列問題:
①NH3催化氧化速率v=k?ca(NH3)?cb(O2),k為常數。當氧氣濃度為1.0mg?L-1時,c(NH3)與速率的關系如表所示,則a=。
②其他反應條件相同時,測得不同溫度下相同時間內NH3的轉化率如圖2所示。則A點對應的反應速率v(正)c(NH3)×102/mol?L-1 0.8 1.6 3.2 6.4 v×108/mol?L-1?min-1 10.2 81.6 652.8 5222.4 (填“>”、“<”或“=”)v(逆),A、C點對應條件下,反應平衡常數較大的是(填“A”或“C”),理由是。組卷:168引用:4難度:0.5


