2022年湖北省武漢市高考化學模擬試卷(5月份)(二)
發布:2024/4/20 14:35:0
一、選擇題:本題共15小題,每小題3分,共45分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.湖北“鉛錫刻鏤技藝”是國家級非物質文化遺產之一,其為青銅器中繁復紋飾及銘文的制作與修復提供了高質高效的解決方案。下列說法錯誤的是( )
A.青銅屬于合金 B.鉛和錫是同族元素 C.鉛錫合金熔點高于錫 D.煉銅原料Cu2(OH)2CO3屬于鹽 組卷:50引用:1難度:0.8 -
2.我國CO2的資源化利用途徑如圖所示。下列說法錯誤的是( )
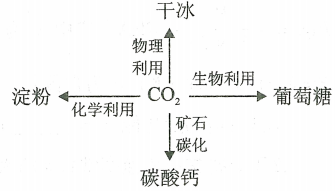
A.干冰是分子晶體 B.淀粉是高分子化合物 C.CO2能與CaO反應生成CaCO3 D.葡萄糖和淀粉實驗式相同 組卷:19引用:1難度:0.8 -
3.生活處處有化學。下列物質不能用作食品添加劑的是( )
A.三聚氰胺 B.苯甲酸 C.亞硝酸鈉 D.谷氨酸鈉 組卷:26引用:1難度:0.7 -
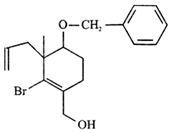 4.紫杉醇是天然抗腫瘤藥物,其合成過程中的一種中間體結構簡式如圖所示。下列關于該中間體敘述錯誤的是( )
4.紫杉醇是天然抗腫瘤藥物,其合成過程中的一種中間體結構簡式如圖所示。下列關于該中間體敘述錯誤的是( )A.能使溴水褪色 B.有1個手性碳原子 C.有2種含氧官能團 D.不能發生消去反應 組卷:11引用:1難度:0.6 -
5.對于下列實驗,能正確描述其反應的離子方程式是( )
A.將鐵絲插入到稀硫酸中:2Fe+6H+═2Fe3++3H2↑ B.向酸性高錳酸鉀溶液中滴加草酸溶液:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O C.向硫酸銅溶液中加入過量氨水:Cu2++2NH3?H2O═Cu(OH)2↓+2NH4+ D.向硫酸鎂溶液中加入氫氧化鋇溶液:Mg2++2OH-═Mg(OH)2↓ 組卷:36引用:1難度:0.6 -
6.下列實驗現象與實驗操作相匹配的是( )
實驗操作 實驗現象 A 將打磨后的鎂帶放入裝有熱水的試管中,反應一段時間后滴入酚酞溶液 鎂帶附近的溶液變成紅色 B 盛有Na2S溶液的試管中邊振蕩邊滴加Na2SO3溶液 產生淺黃色沉淀 C 向盛有K2Cr2O7溶液的試管中滴入濃NaOH溶液 溶液由黃色變為橙色 D 向盛有少量苯酚稀溶液的試管中滴加FeCl3溶液 溶液變紅 A.A B.B C.C D.D 組卷:8引用:1難度:0.5
二、非選擇題:本題共4小題,共55分。
-
18.無水氯化銅是一種用途廣泛的化學試劑,乙醇溶解CuCl2?2H2O減壓脫水法制備CuCl2裝置如圖所示。
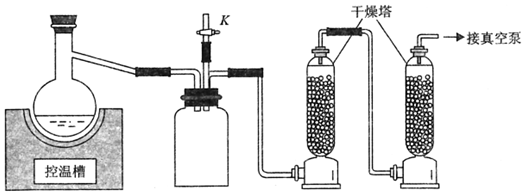
Ⅰ.在托盤天平上稱取5.0gCuCl2?2H2O,研磨后加入100mL蒸餾燒瓶中。
Ⅱ.用量筒取50mL99%的無水乙醇,加入蒸餾燒瓶后振蕩,使其溶解。
Ⅲ.將蒸餾燒瓶裝在減壓裝置上,關閉K,調節控溫槽至合適溫度,然后用真空泵抽氣至溶液沸騰,抽氣30min以上,以趕盡所有的溶劑。
Ⅳ.關閉真空泵,取下蒸餾燒瓶,在干燥箱中65℃烘干半小時,用藥匙剝下附在蒸餾燒瓶上的產品,研磨后得粉末狀產品。
回答下列問題:
(1)步驟I中“研磨”的目的是。
(2)已知常壓時,蒸餾燒瓶中液體的恒沸溫度為78℃。步驟Ⅲ中“合適溫度”可能是(填字母)。
a.0℃
b.65℃
c.78℃
d.100℃
(3)干燥塔中裝有足量的無水CaCl2,其作用是。
(4)步驟Ⅳ中取下蒸餾燒瓶前,為保障實驗安全,必須進行的簡便操作是。
(5)直接加熱CuCl2?2H2O無法制得CuCl2,而是得到Cu(OH)2?CuCl2。該反應的化學方程式是。
(6)采用Volhard返滴定法測定樣品中氯化銅的含量:取樣品0.135g于錐形瓶中,加入40.00mL0.1000mol/L的AgNO3溶液,再加指示劑,用0.1000mol/L的NH4SCN溶液滴定,消耗NH4SCN溶液20.04mL。(已知:Ag++SCN-═AgSCN↓)
①滴定選用的指示劑是。
a.甲基橙
b.酚酞
c.淀粉溶液
d.NH4Fe(SO4)2溶液
②樣品中CuCl2的含量為%。
③若干燥樣品時,少量CuCl2分解為CuCl,則導致測出CuCl2的含量(填“偏高”、“偏低”或“無影響”)。組卷:27引用:1難度:0.5 -
19.甲醇制烯烴是一項非石油路線烯豎生產技術,可以減少我國對石油進口的依賴度。回答下列問題:
(1)甲醇可通過煤液化過程獲得,該過程是(填“物理”或“化學”)變化。
(2)甲醇生成烯烴的反應是不可逆反應,烯烴產物之間存在如下轉化關系:
反應Ⅰ.2C3H6(g)?3C2H4(g)ΔH1=117kJ/mol
反應Ⅱ.3C4H8(g)?4C3H6(g)ΔH2=78kJ/mol
Ⅲ.C4H8(g)?2C2H4(g)ΔH3
反應達平衡時,三種組分的物質的量分數x隨溫度T的變化如圖1所示。
①反應Ⅲ的ΔH3=kJ/mol。
②圖中曲線a代表的組分是,700K后,曲線a下降的原因是。
③圖中P點坐標為(900,0.48),900K時,反應Ⅲ的物質的量分數平衡常數Kx=(以物質的量分數代替濃度計算)。
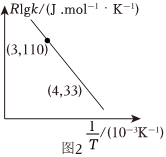
(3)甲醇制丙烯的反應為3CH3OH(g)=C3H6(g)+3H2O(g),速率常數k與反應溫度T的關系遵循Arrhenius方程,實驗數據如圖2所示。已知Arrhenius方程為Rlgk=-+RlgA[其中k為速率常數,反應速率與其成正比;Ea為活化能,R=8.314J/(mol?K),A為常數]。Ea2.303T
①該反應的活化能Ea=kJ/mol(計算結果保留一位小數)。
②下列措施能使速率常數k增大的是。
A.增大c(CH3OH)
B.升高溫度
C.增大壓強
D.更換適宜催化劑組卷:51引用:2難度:0.5


