2021-2022學年遼寧省沈陽二中高一(下)期中化學試卷
發布:2024/11/11 15:0:2
一、選擇題(本題包括15小題,每小題3分,共45分,每小題只有一個選項符合題意。)
-
1.將足量CO2氣體通入水玻璃(Na2SiO3溶液)中,然后加熱蒸干,再在高溫下充分灼燒,最后所得的固體物質是( )
A.Na2CO3、Na2SiO3 B.Na2CO3、SiO2 C.Na2SiO3 D.SiO2 組卷:146引用:5難度:0.9 -
2.下列實驗能證明某氣體為SO2的是( )
①使澄清石灰水變渾濁
②使濕潤的藍色石蕊試紙變紅
③使品紅溶液褪色
④通入足量NaOH溶液中,再滴加BaCl2溶液,有白色沉淀生成,該沉淀溶于稀鹽酸
⑤通入溴水中,能使溴水褪色,再滴加Ba(NO3)2溶液有白色沉淀產生.A.都能證明 B.都不能證明 C.③④⑤均能證明 D.只有⑤能證明 組卷:163引用:17難度:0.7 -
3.汽車排放的尾氣中含有NO2,NO2是城市大氣污染的主要污染物之一。在日光照射下,NO2發生一系列光化學煙霧的循環反應,從而不斷產生O3,加重空氣污染。反應過程為①2NO2→2NO+2O,②2NO+O2→2NO2,③O+O2→O3.下列對該反應過程及生成物敘述正確的是( )
A.NO2起催化劑作用 B.NO起催化劑作用 C.NO2只起氧化劑作用 D.O3與O2為同位素 組卷:139引用:5難度:0.9 -
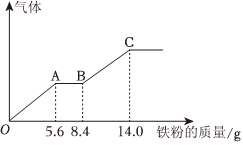 4.某稀硫酸和稀硝酸的混合溶液200mL,平均分成兩份。向其中一份中逐漸加入銅粉,最多能溶解9.6g。向另一份中逐漸加入鐵粉,產生氣體的量隨鐵粉質量增加的變化如圖所示(已知硝酸只被還原為NO氣體)。下列分析或結果錯誤的是( )
4.某稀硫酸和稀硝酸的混合溶液200mL,平均分成兩份。向其中一份中逐漸加入銅粉,最多能溶解9.6g。向另一份中逐漸加入鐵粉,產生氣體的量隨鐵粉質量增加的變化如圖所示(已知硝酸只被還原為NO氣體)。下列分析或結果錯誤的是( )A.第二份溶液中最終溶質為FeSO4 B.OA段產生的是NO,AB段的反應為Fe+2Fe3+═3Fe2+,BC段產生氫氣 C.原混合酸中 物質的量為0.1 molNO-3D.H2SO4 濃度為2.5 mol?L-1 組卷:43引用:4難度:0.5 -
5.煉鐵的總反應為 Fe2O3(s)+3CO(g)→2Fe(s)+3CO2(g)+Q kJ,可能發生了以下過程:
3Fe2O3(s)+CO(g)→2Fe3O4(s)+CO2(g)+Q1 kJ;
Fe3O4(s)+CO(g)→3FeO(s)+CO2(g)+Q2 kJ;
FeO(s)+CO(g)→Fe(s)+CO2(g)+Q3 kJ.
則Q與Q1、Q2、Q3的關系式正確的是( )A.Q=Q1+Q2+Q3 B.Q=Q1-Q2-Q3 C.Q= Q+2Q2+6Q33D.Q= Q+2Q2+6Q32組卷:230引用:4難度:0.9 -
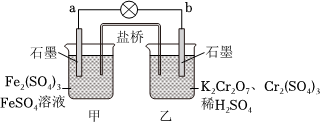 6.某學習小組的同學查閱相關資料知氧化性:Cr2>Fe3+,設計了鹽橋式的原電池,如圖所示。鹽橋中裝有瓊脂與飽和K2SO4溶液。下列敘述中正確的是( )O2-7
6.某學習小組的同學查閱相關資料知氧化性:Cr2>Fe3+,設計了鹽橋式的原電池,如圖所示。鹽橋中裝有瓊脂與飽和K2SO4溶液。下列敘述中正確的是( )O2-7A.外電路的電流方向為從b到a B.乙燒杯中發生的電極反應為2Cr3++7H2O-6e-═Cr2 +14H+O2-7C.甲燒杯的溶液中發生還原反應 D.電池工作時,鹽橋中的 移向乙燒杯SO2-4組卷:197引用:4難度:0.6
二、填空題(本題包括4小題,共55分)
-
18.過二硫酸鉀(K2S2O8)是一種白色結晶性粉末,溶于水、不溶于乙醇,具有強氧化性,加熱至100℃時會完全分解。某學習小組擬探究過二硫酸鉀的性質。
實驗(一):探究過二硫酸鉀的強氧化性。
探究K2S2O8溶液與KI溶液反應,實驗操作與現象如下:
(1)同學乙猜想實驗Ⅱ中Fe2+起催化作用,其總反應分兩步進行:實驗 操作 現象 I 在10mL含淀粉的0.1mol?L-1的KI溶液中滴加10mL0.1mol?L-1K2S2O8溶液 一段時間后,溶液緩慢變藍 II 在10mL含淀粉的0.1mol?L-1的KI溶液中先滴幾滴0.1mol?L-1的FeSO4溶液,再滴加10mL0.1mol?L-1K2S2O8溶液 溶液迅速變藍
(i)2Fe2++S2═2Fe3++2O2-8;SO2-4
(ii)。
①補充反應(ii)。
②請你設計實驗證明同學乙的猜想:。
(2)查閱文獻知,氧化性:S2>O2-8。在稀硫酸酸化的MnSO4溶液中滴加1滴AgNO3溶液作催化劑,再滴加K2S2O8溶液,實驗現象是MnO-4,該反應的離子方程式為。
實驗(二):探究過二硫酸鉀的熱穩定性。
已知幾種氣體的熔點、沸點如下表所示:
取適量的K2S2O8裝入硬質玻璃管中,加熱,將分解產物依次通過裝置B、C、D。實驗中發現B中U形管內產生無色液體,接著無色液體慢慢變成固體,C中溶液顏色無明顯變化,D中溶液逐漸變藍色。氣體 SO3 SO2 O2 熔點/℃ 168 -727 -2184 沸點/℃ 448 -10 -1829 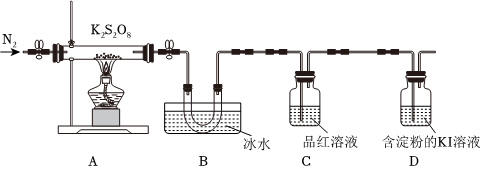
(3)加熱之前,先通入一段時間N2,當觀察到D中(填實驗現象)時點燃酒精燈。
(4)B中U形管收集的物質是(填化學式)。
(5)當A中硬質玻璃管中固體完全分解,停止加熱,殘留的固體產物只有一種。待冷卻至室溫時取少量殘留固體于試管,加入蒸餾水,溶解后滴加稀鹽酸BaCl2溶液和,產生白色沉淀。A中K2S2O8完全分解發生反應的化學方程式為。組卷:29引用:1難度:0.6 -
19.Li4Ti5O12和LiFePO4都是鋰離子電池的電極材料,可利用鈦鐵礦(主要成分為FeTiO3,還含有少量MgO、SiO2等雜質)來制備,工藝流程如圖:
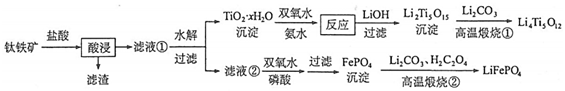
回答下列問題:
(1)“酸浸”實驗中,鐵的浸出率結果如圖所示。由圖可知,當鐵的浸出率為70%時,所采用的實驗條件為。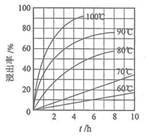
(2)“酸浸”后,濾渣的主要成分為,鈦主要以形式存在,寫出相應反應的離子方程式TiOCl2-4。
(3)TiO2?xH2O沉淀與雙氧水、氨水反應40min所得實驗結果如下表所示:
分析40℃時TiO2?xH2O轉化率最高的原因溫度/℃ 30 35 40 45 50 TiO2?xH2O轉化率% 92 95 97 93 88 。
(4)Li2Ti5O15中Ti的化合價為+4,其中過氧鍵的數目為。
(5)寫出“高溫煅燒②”中由FePO4制備LiFePO4的化學方程式;LiFePO4作為鋰離子電池的正極材料,充電時LiFePO4脫出部分Li+,形成Li1-xFePO4,若x為,則n(Fe2+):n(Fe3+)=316。組卷:20引用:1難度:0.6


