2020-2021學年北京市101中學高一(下)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(共42分)(共21道小題,每小題只有一個選項符合題意,每小題2分。)
-
1.下列發電廠(站)是將化學能直接轉化為電能的是( )
A B C D 



燃料電池發電站 地熱發電廠 風力發電廠 水力發電站 A.A B.B C.C D.D 組卷:35引用:3難度:0.8 -
2.化學與生活密切相關。下列說法不正確的是( )
A.高溫可殺滅細菌,是由于高溫可使蛋白質變性 B.淀粉水解的最終產物是葡萄糖 C.油脂、蛋白質、糖類屬于高分子化合物 D.維生素C常與補鐵劑(有效成分中鐵元素為+2價)同服,是由于它具有還原性 組卷:21引用:3難度:0.8 -
3.NA代表阿伏加德羅常數的數值。下列說法正確的是( )
A.標準狀況下2.24L氯氣與水充分反應轉移電子數為0.1NA B.1mol-OH和1molOH-含有的電子數均為10NA C.標準狀況下2.24L的CCl4中含有的C-Cl鍵數為0.4NA D.2.8gC2H4中含有0.4NA個極性鍵 組卷:12引用:2難度:0.9 -
4.下列化學用語表示正確的是( )
A.Ca2+的結構示意圖: 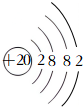
B.基態碳原子的軌道表示式: 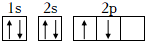
C.甲烷的球棍模型: 
D.基態銅原子(29Cu)的價層電子排布式:3d104s1 組卷:5引用:2難度:0.7 -
5.X、Y、Z三種元素的原子,其最外層電子排布分別為ns1、3s23p1和2s22p4,由這三種元素組成的化合物的化學式可能是( )
A.XYZ2 B.X2YZ3 C.X2YZ2 D.XYZ3 組卷:267引用:47難度:0.9 -
6.根據下表中烴的分子式排列,判斷空格中烴的同分異構體數目是( )
1 2 3 4 5 6 7 8 CH4 C2H4 C3H8 C4H8 C6H12 C7H16 C8H16 A.3 B.4 C.5 D.6 組卷:197引用:54難度:0.9 -
7.下列與原子核外電子排布規律相關的敘述中(n為能層序數),不正確的是( )
A.第三周期元素的基態原子中,未成對電子數最多的是磷 B.電子填入能級的順序是np→(n+1)s,因此原子核外最外層電子數一般不超過8 C.由3d能級有5個軌道可知,元素周期表中第四周期元素比第三周期元素多10種 D.基態原子的最外層電子排布為ns2的元素,在元素周期表中均位于第ⅡA族 組卷:114引用:4難度:0.7 -
8.元素周期律的發現是近代化學史上的一座里程碑。下列事實不能用元素周期律解釋的是( )
A.Na2CO3溶液中加鹽酸,產生氣泡 B.常溫下,形狀和大小相同的Mg、Al與同濃度鹽酸反應,Mg條更劇烈 C.氣態氫化物的穩定性:H2O>H2S D.Br2從NaI溶液中置換出I2 組卷:14引用:2難度:0.8
二、非選擇題(共58分)
-
25.以鋅錳廢電池中的碳包(含碳粉、Fe、Cu、Ag和MnO2等物質 )為原料回收MnO2的工藝流程如下:
I.將碳包中物質烘干,用足量稀HNO3溶解金屬單質,過濾,得濾渣a;
Ⅱ.將濾渣a在空氣中灼燒除去碳粉,得到粗MnO2;
Ⅲ.向粗MnO2中加入酸性H2O2溶液,MnO2溶解生成Mn2+,有氣體生成;
Ⅳ.向III所得溶液(pH約為6)中緩慢滴加0.50mol?L-1 Na2CO3溶液,過濾,得濾渣b,其主要成分為
MnCO3;
V.濾渣b經洗滌、干燥、灼燒,制得較純的MnO2.
(1)Ⅰ中Ag與足量稀HNO3反應生成NO的化學方程式為.
(2)已知Ⅱ的灼燒過程中同時發生反應:
MnO2(s)+C(s)═MnO(s)+CO(g)△H=+24.4kJ?mol- 1
MnO2(s)+CO(g)═MnO(s)+CO2(g)△H=-148.1kJ?mol- 1
寫出MnO2和C反應生成MnO和CO2的熱化學方程式:.
(3)H2O2分子中含有的化學鍵類型為、.
(4)Ⅲ中MnO2溶解的化學方程式為,溶解一定量的MnO2,H2O2的實際消耗量比理論值高,用化學方程式解釋原因:.
(5)Ⅳ中,若改為“向0.50mol?L-1 Na2CO3溶液中緩慢滴加Ⅲ所得溶液”,濾渣b中會混有較多Mn(OH)2沉淀,解釋其原因:.
(6)V中MnCO3在空氣中灼燒的化學方程式為.組卷:48引用:3難度:0.3 -
26.某學習小組通過下列裝置探究MnO2與FeCl3?6H2O能否反應產生Cl2。
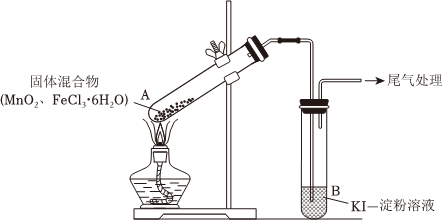
實驗操作和現象:(A試管中加入MnO2與FeCl3?6H2O的固體混合物)
(1)現象ⅰ中的白霧是操 作 現 象 點燃酒精燈,加熱 ⅰ.A中部分固體溶解,上方出現白霧
ⅱ.稍后,產生黃色氣體,管壁附著黃色
液滴
ⅲ.B中溶液變藍,形成白霧的原因是
(2)分析現象ⅱ,該小組探究黃色氣體的成分,實驗如下:
a.加熱FeCl3?6H2O,產生白霧和黃色氣體。
b.用KSCN溶液檢驗現象ⅱ和a中的黃色氣體,溶液均變紅。通過該實驗說明現象ⅱ中黃色氣體含有
(3)除了氯氣可使B中溶液變藍外,推測還可能的原因是:
①實驗b檢出的氣體使之變藍,反應的離子方程式是,實驗證實推測成立。
②溶液變藍的另外一種原因是:在酸性條件下,裝置中的空氣使之變藍。通過進一步實驗確認
了這種可能性,其實驗方案是
(4)為進一步確認黃色氣體是否含有Cl2,小組提出兩種方案,均證實了Cl2的存在。
【方案1】在A、B間增加盛有某種試劑的洗氣瓶C。
【方案2】將B中KI-淀粉溶液替換為NaBr溶液,檢驗Fe2+.現象如下:
①方案1的C中盛放的試劑是方案1 B中溶液變為藍色 方案2 B中溶液呈淺橙紅色;未檢出Fe2+
②方案2中檢驗Fe2+ 的原因是
③綜合方案1、2的現象,說明選擇NaBr溶液的依據是
(5)將A中產物分離得到Fe2O3和MnCl2,A中產生Cl2的化學方程式是組卷:42引用:5難度:0.5


