2022年江蘇省新高考化學試卷(選擇性)
發布:2024/11/4 13:0:2
一、單項選擇題:共13題,每題3分,共39分。每題只有一個選項最符合題意。
-
1.我國為人類科技發展作出巨大貢獻。下列成果研究的物質屬于蛋白質的是( )
A.陶瓷燒制 B.黑火藥 C.造紙術 D.合成結晶牛胰島素 組卷:363引用:5難度:0.7 -
2.少量Na2O2與H2O反應生成H2O2和NaOH。下列說法正確的是( )
A.Na2O2的電子式為 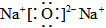
B.H2O的空間構型為直線形 C.H2O2中O元素的化合價為-1 D.NaOH僅含離子鍵 組卷:502引用:5難度:0.5 -
3.工業上電解熔融Al2O3和冰晶石(Na3AlF6)的混合物可制得鋁。下列說法正確的是( )
A.半徑大小:r(Al3+)<r(Na+) B.電負性大小:χ(F)<χ(O) C.電離能大小:I1(O)<I1(Na) D.堿性強弱:NaOH<Al(OH)3 組卷:407引用:5難度:0.6 -
4.實驗室制取少量SO2水溶液并探究其酸性,下列實驗裝置和操作不能達到實驗目的的是( )
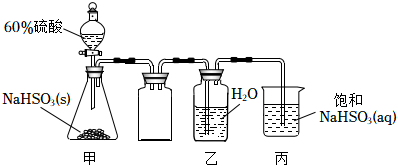
A.用裝置甲制取SO2氣體 B.用裝置乙制取SO2水溶液 C.用裝置丙吸收尾氣中的SO2 D.用干燥pH試紙檢驗SO2水溶液的酸性 組卷:798引用:7難度:0.7 -
5.閱讀下列材料,完成5~7題:
周期表中ⅣA族元素及其化合物應用廣泛,甲烷具有較大的燃燒熱(890.3kJ?mol-1),是常見燃料;Si、Ge是重要的半導體材料,硅晶體表面SiO2能與氫氟酸(HF,弱酸)反應生成H2SiF6(H2SiF6在水中完全電離為H+和SiF62-);1885年德國化學家將硫化鍺(GeS2)與H2共熱制得了門捷列夫預言的類硅-鍺;我國古代就掌握了青銅(銅-錫合金)的冶煉、加工技術,制造出許多精美的青銅器;Pb、PbO2是鉛蓄電池的電極材料,不同鉛化合物一般具有不同顏色,歷史上曾廣泛用作顏料。
下列說法正確的是( )A.金剛石與石墨烯中的C-C-C夾角都為120° B.SiH4、SiCl4都是由極性鍵構成的非極性分子 C.鍺原子(32Ge)基態核外電子排布式為4s24p2 D.ⅣA族元素單質的晶體類型相同 組卷:182引用:0難度:0.60
二、非選擇題:共4題,共61分。
-
16.實驗室以二氧化鈰(CeO2)廢渣為原料制備Cl-含量少的Ce2(CO3)3,其部分實驗過程如圖:

(1)“酸浸”時CeO2與H2O2反應生成Ce3+并放出O2,該反應的離子方程式為。
(2)pH約為7的CeCl3溶液與NH4HCO3溶液反應可生成Ce2(CO3)3沉淀,該沉淀中Cl-含量與加料方式有關。得到含Cl-量較少的Ce2(CO3)3的加料方式為(填序號)。
A.將NH4HCO3溶液滴加到CeCl3溶液中
B.將CeCl3溶液滴加到NH4HCO3溶液中
(3)通過中和、萃取、反萃取、沉淀等過程,可制備Cl-含量少的Ce2(CO3)3。已知Ce3+能被有機萃取劑(簡稱HA)萃取,其萃取原理可表示為Ce3+(水層)+3HA(有機層)?Ce(A)3(有機層)+3H+(水層)。
①加氨水“中和”去除過量鹽酸,使溶液接近中性。去除過量鹽酸的目的是。
②反萃取的目的是將有機層Ce3+轉移到水層。使Ce3+盡可能多地發生上述轉移,應選擇的實驗條件或采取的實驗操作有(填兩項)。
③與“反萃取”得到的水溶液比較,過濾Ce2(CO3)3沉淀的濾液中,物質的量減小的離子有(填化學式)。
(4)實驗中需要測定溶液中Ce3+的含量。已知水溶液中Ce4+可用準確濃度的(NH4)2Fe(SO4)2溶液滴定。以苯代鄰氨基苯甲酸為指示劑,滴定終點時溶液由紫紅色變為亮黃色,滴定反應為Fe2++Ce4+=Fe3++Ce3+。請補充完整實驗方案:①準確量取25.00mLCe3+溶液[c(Ce3+)約為0.2mol?L-1],加氧化劑將Ce3+完全氧化并去除多余氧化劑后,用稀硫酸酸化,將溶液完全轉移到250mL容量瓶中后定容;②按規定操作分別將0.02000mol?L-1(NH4)2Fe(SO4)2和待測Ce4+溶液裝入如圖所示的滴定管中:③。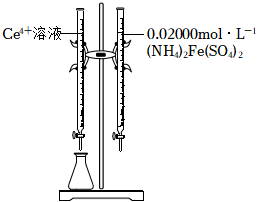 組卷:590引用:2難度:0.6
組卷:590引用:2難度:0.6 -
17.氫氣是一種清潔能源,綠色環保制氫技術研究具有重要意義。
(1)“CuCl-H2O熱電循環制氫”經過溶解、電解、熱水解和熱分解4個步驟,其過程如圖所示。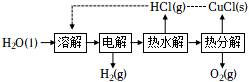
①電解在質子交換膜電解池中進行。陽極區為酸性Cu溶液,陰極區為鹽酸,電解過程中CuCl-2轉化為CuCl-2。電解時陽極發生的主要電極反應為Cl2-4(用電極反應式表示)。
②電解后,經熱水解和熱分解的物質可循環使用。在熱水解和熱分解過程中,發生化合價變化的元素有(填元素符號)。
(2)“Fe-HC-H2O熱循環制氫和甲酸”的原理為:在密閉容器中,鐵粉與吸收CO2制得的NaHCO3溶液反應,生成H2、HCOONa和Fe3O4;Fe3O4再經生物柴油副產品轉化為Fe。O-3
①實驗中發現,在300℃時,密閉容器中NaHCO3溶液與鐵粉反應,反應初期有FeCO3生成并放出H2,該反應的離子方程式為。
②隨著反應進行,FeCO3迅速轉化為活性Fe3O4-x,活性Fe3O4-x是HC轉化為HCOO-的催化劑,其可能反應機理如圖所示。根據元素電負性的變化規律。如圖所示的反應步驟Ⅰ可描述為O-3。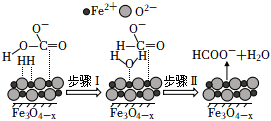
③在其他條件相同時,測得Fe的轉化率、HCOO-的產率隨C(HC)變化如圖所示。HCOO-的產率隨c(HCO-3)增加而增大的可能原因是O-3。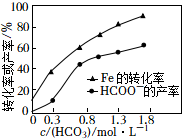
(3)從物質轉化與資源綜合利用角度分析,“Fe-HC-H2O熱循環制氫和甲酸”的優點是O-3。組卷:373引用:2難度:0.4


