2022-2023學年江蘇省南京市六校高二(上)調研化學試卷
發布:2024/4/20 14:35:0
一、單項選擇題:共14題,每題3分,共42分。每題只有一個選項符合題意。
-
1.生活中處處有化學,下列敘述正確的是( )
A.HB鉛筆芯的成分為二氧化鉛 B.碳酸氫鈉可用作食品膨松劑 C.青銅和黃銅是不同結構的單質銅 D.焰火中紅色來源于鈉鹽灼燒 組卷:464引用:3難度:0.6 -
2.少量Na2O2與H2O反應生成H2O2和NaOH。下列說法正確的是( )
A.Na2O2的電子式為 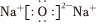
B.H2O分子中含非極性共價鍵 C.NaOH中只含離子鍵 D.H2O2的結構式 H-O-O-H 組卷:29引用:3難度:0.7 -
3.下列有關物質的性質與用途具有對應關系的是( )
A.NH4Cl溶液呈酸性,可用于除鐵銹劑 B.SO2具有氧化性,可用作葡萄酒抗氧化劑 C.小蘇打可以和堿反應,可用作抗酸藥 D.FeCl3具有氧化性,可用作凈水劑 組卷:11引用:2難度:0.7 -
4.四種短周期元素W、X、Y、Z的原子序數依次增大,W元素的最外層電子數是其電子層數的二倍;X的原子半徑是短周期主族元素原子中最大的;Y是地殼中含量最多的金屬元素;X與Z形成的離子化合物的水溶液呈中性。下列敘述中,不正確的是( )
A.W的非金屬性小于Z的非金屬性 B.將X單質投入到CuSO4溶液中,生成紫紅色固體 C.工業上用電解熔融Y的氧化物的方法冶煉金屬Y D.Z的最高價氧化物對應水化物為強酸 組卷:27引用:2難度:0.7 -
5.KMnO4溶液、NaClO溶液分別與濃鹽酸混合反應都能生成Cl2。下列制取、凈化Cl2、驗證其氧化性并進行尾氣吸收的裝置和原理能達到實驗目的的是( )
A. 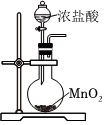 制取Cl2
制取Cl2B. 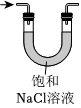 除去HCl
除去HClC. 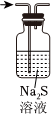 驗證Cl2氧化性
驗證Cl2氧化性D.  吸收尾氣組卷:92引用:1難度:0.7
吸收尾氣組卷:92引用:1難度:0.7
二、非選擇題:共4題,共58分
-
17.以硫鐵礦(主要成分是FeS2,含少量Al2O3、SiO2和Fe3O4)為原料制備磷酸鐵(FePO4)。
(1)酸浸。將一定量焙燒后的硫鐵礦粉末加入到三頸瓶中,恒溫50~60℃加熱(裝置見圖1),通過滴液漏斗緩慢滴加一定濃度的稀硫酸,充分反應,過濾。溫度不宜過高的原因是。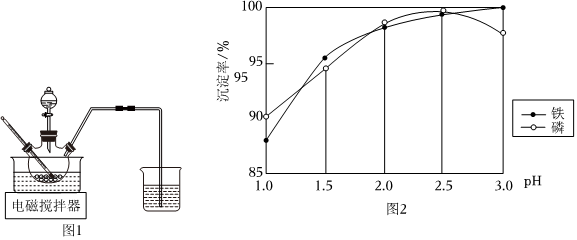
(2)還原。向濾液中加入還原鐵粉,充分攪拌至溶液中Fe3+全部被還原。檢驗Fe3+全部被還原的實驗方法是,還原反應的離子方程式為。
(3)除鋁。向還原后的溶液中加入FeO固體,不斷攪拌,使Al3+完全轉化為Al(OH)3,過濾,得FeSO4溶液。加入FeO后發生反應的離子方程式為。
(4)制備FePO4。反應原理為Fe2(SO4)3+2Na2HPO4═2FePO4↓+2Na2SO4+H2SO4,純凈的FePO4為白色沉淀,不同pH對磷酸鐵沉淀的影響如圖2所示。pH約為3后鐵的沉淀率接近完全,而磷的沉淀率卻在下降的可能原因是:。
(5)為了得到較純凈的FePO4,請補充完整以除鋁后的FeSO4溶液制備FePO4的實驗方案:取一定量除鋁后的FeSO4溶液,,固體干燥,得到FePO4。[可選用的試劑:1mol?L-1Na2HPO4溶液(pH約為10)、3%H2O2溶液、BaCl2溶液]組卷:9引用:2難度:0.4 -
18.有效去除大氣中的NOx和水體中的氮是環境保護的重要課題。
(1)已知:①2CO(g)+O2(g)═2CO2(g)ΔH1=-566.0kJ?mol-1
②N2(g)+2O2(g)═2NO2(g)ΔH2=+64kJ?mol-1
反應2NO2(g)+4CO(g)═N2(g)+4CO2(g)ΔH3=。
(2)磷酸銨鎂(MgNH4PO4)沉淀法可去除水體中的氨氮(和NH3)。實驗室中模擬氨氮處理:1L的模擬氨氮廢水(主要含NH+4),置于攪拌器上,設定反應溫度為25℃。先后加入MgCl2和Na2HPO4溶液,用NaOH調節反應pH,投加絮凝劑;開始攪拌,反應30min后,取液面下2cm處清液測定氨氮質量濃度。NH+4
①生成磷酸銨鎂沉淀的離子反應方程式為。
②測得反應pH對氨氮去除率的影響如圖1所示,當pH從7.5增至9.0的過程中,水中氨氮的去除率明顯增加,原因是。
③當反應pH為9.0時,該沉淀法對氨氮的去除率達到最高,當pH繼續增至10.0時,氨氮的去除率下降,原因是。
(3)納米零價鐵(NZVI)/BC與(CuPd)/BC聯合作用可去除水體中的硝態氮。
在NZVI/BC和(CuPd)/BC復合材料聯合作用的體系中,生物炭(BC)作為NZVI、Cu、Pb的載體且減少了納米零價鐵的團聚,納米零價鐵作為主要還原劑,Cu和Pd作為催化劑且參與吸附活性H。
①NZVI/BC和(CuPd)/BC復合材料還原硝酸鹽的反應機理如圖2所示,轉化為N2或NO-3的過程可描述為NH+4。
②實驗測得體系初始pH對去除率的影響如圖3,前200min內,pH=9.88時的去除率遠低于pH=4.05時,其可能的原因是NO-3。組卷:75引用:7難度:0.6


