2021年四川省成都市高考化學模擬試卷
發布:2024/12/13 8:0:14
一、選擇題:本題共7個小題,每小題3分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.化學與生活、科技、社會、環境等密切相關,下列有關敘述錯誤的是( )
A.使用含有氯化鈉的融雪劑會加快金屬橋梁的腐蝕 B.Fe3+水解可以產生帶有正電荷的Fe(OH)3膠體,可以用于凈水 C.用次氯酸鹽對棉及棉型織物漂白和用SO2漂白紙漿原理不同 D.為防止感染“新冠病毒”,堅持每天使用75%的酒精殺菌消毒 組卷:35引用:1難度:0.8 -
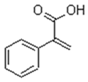 2.阿托酸是一種常用的醫藥中間體,其結構簡式如圖所示。下列有關說法正確的是( )
2.阿托酸是一種常用的醫藥中間體,其結構簡式如圖所示。下列有關說法正確的是( )A.1mol阿托酸和溴水反應,最多消耗4molBr2 B.阿托酸分子中所有碳原子一定在同一平面上 C.可以通過酸性KMnO4溶液區分苯和阿托酸 D.阿托酸分子中能發生取代、加成、水解等反應 組卷:42引用:1難度:0.5 -
3.如表實驗操作不能達到實驗目的的是( )
選項 實驗 目的 A 向含Br2的苯中加入適量的NaOH溶液,然后充分振蕩、靜置、分液 除去雜質Br2 B 相同溫度下,用pH計測定等濃度的CH3COONa和NaClO 比較CH3COOH和HClO酸性 C 將含有少量NaCl雜質的KNO3固體溶于水,蒸發濃縮,冷卻結晶、過濾 提純KNO3 D 向某溶液中滴加幾滴NaOH稀溶液,用濕潤的紅色石蕊試紙靠近試管口檢驗 檢驗NH4+ A.A B.B C.C D.D 組卷:36引用:1難度:0.5
二、必考題(本題共3小題,共39分)
-
9.將少量氯水加入到NaI溶液中”的學生實驗產生了大量含碘廢液.某研究小組用該含碘廢液制備NaI固體,實驗流程如圖。
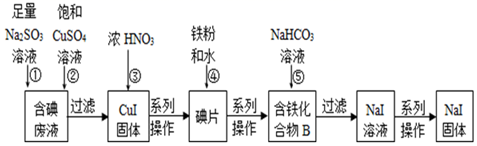
已知:反應②2I-+2Cu2++SO32-+H2O═2CuI↓+SO42-+2H+。回答下列問題:
(1)產生含碘廢液的離子方程式為。
(2)①中I2與Na2SO3溶液反應的離子方程式為。
(3)③中加入濃硝酸的作用是。
(4)化合物B中含兩種元素,鐵元素與另一種元素物質的量之比為3:8,則化合物B的化學式為。
(5)反應⑤中生成黑色固體和無色氣體,黑色固體的俗稱為磁性氧化鐵,則⑤的化學方程式為。
(6)測定產品中NaI含量的實驗步驟如下:
a.稱取4.000g樣品、溶解,在250mL容量瓶中定容;
b.量取25.00mL待測液于錐形瓶中;
c.用0.1000mol?L-1AgNO3溶液滴定至終點,記錄消耗AgNO3溶液的體積;
d.重復b、c操作2~3次,記錄相關實驗數據。
①滴定過程中,AgNO3溶液應放在(填“酸式”或“堿式”)滴定管中;步驟d的目的是。
②若用上述方法測定產品中的NaI含量偏低(忽略測定過程中的誤差),其可能的原因是。組卷:26引用:1難度:0.4 -
10.碳、氮是中學化學重要的非金屬元素,在生產、生活中有廣泛的應用。
(1)治理汽車尾氣中NO和CO的一種方法是:在汽車的排氣管道上安裝一個催化轉化裝置,使NO與CO反應,產物都是空氣中的主要成分。寫出該反應的熱化學方程式。
已知:①N2(g)+O2(g)═2NO(g)△H=+179.5kJ/mol
②2NO(g)+O2(g)═2NO2(g)△H=-112.3kJ/mol
③NO2(g)+CO(g)═NO(g)+CO2(g)△H=-234kJ/mol
(2)已知植物光合作用發生的反應如下:6CO2(g)+6H2O(l)═C6H12O6(s)+6O2(g)△H=+669.62kJ/mol。該反應達到化學平衡后,若改變下列條件,CO2轉化率增大的是。
a.增大CO2的濃度
b.取走一半C6H12O6
c.加入催化劑
d.適當升高溫度
(3)N2O5的分解反應2N2O5(g)?4NO2(g)+O2(g),由實驗測得在67℃時N2O5的濃度隨時間的變化如表。
計算在0~2min時段,化學反應速率v(NO2)=時間/min 0 1 2 3 4 5 c(N2O5)/(mol?L-1) 1.00 0.71 0.50 0.35 0.25 0.17 mol?L-1?min-1。
(4)新的研究表明,可以將CO2轉化為炭黑進行回收利用,反應原理如圖1所示。
①在轉化過程中起催化作用的物質是;
②②寫出總反應的化學方程式。
(5)以NH3為還原劑在脫硝裝置中消除煙氣中的氮氧化物。
主反應:4NH3(g)+4NO(g)+O2(g)═4N2(g)+6H2O(g)△H1
副反應:4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1267.1kJ/mol
4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H3=-907.3kJ/mol
①△H1=。
②將煙氣按一定的流速通過脫硝裝置,測得出口NO的濃度與溫度的關系如圖2,試分析脫硝的適宜溫度是。(填序號)
a.<850℃
b.900~1000℃
c.>1050℃
(6)以連二亞硫酸鹽(S2O42-)為還原劑脫除煙氣中的NO,并通過電解再生,裝置如圖3。陰極的電極反應式為,電解槽中的隔膜為(填“陽”或“陰”)離子交換膜。組卷:34引用:1難度:0.5


