2021-2022學年四川省成都外國語學校高二(上)月考化學試卷(12月份)
發布:2024/4/20 14:35:0
一、選擇題(共25小題,每小題2分,滿分50分)
-
1.下列有關化學反應速率的說法正確的是( )
A.用鐵片和稀硫酸反應制取氫氣時,改用98%的濃硫酸可以加快產生氫氣的速率 B.100 mL 2 mol/L的鹽酸跟鋅片反應,加入適量的氯化鈉溶液,反應速率不變 C.SO2的催化氧化是一個放熱反應,所以升高溫度,反應速率減慢 D.催化劑能降低分子活化時所需能量,使單位體積內活化分子百分數大大增加 組卷:160引用:9難度:0.9 -
2.恒溫、恒壓下,1mol A 和1mol B在一個容積可變的容器中發生反應:A(g)+2B(g)?2C(g)。一段時間后達到平衡,生成amol C.下列說法不正確的是( )
A.起始時和達到平衡時容器中的壓強之比為1:1 B.平衡時物質A,B的轉化率之比為1:2 C.平衡時A的轉化率為 a2D.當v正(A)=v逆(B)時,可判定反應達到平衡狀態 組卷:18引用:3難度:0.5 -
3.對于恒容密閉容器中發生的可逆反應N2(g)+3H2(g)?2NH3(g)△H<0,下列能說明反應達到化學平衡狀態的是( )
A.斷開一個N≡N鍵的同時有6個N-H鍵生成 B.混合氣體的密度不變 C.混合氣體的平均摩爾質量不變 D.N2、H2、NH3的分子個數比為1:3:2 組卷:14引用:3難度:0.7 -
4.反應SiCl4(g)+2H2(g)
Si(s)+4HCl(g)可用于純硅的制備。下列有關該反應的說法正確的是( )高溫A.該反應△H>0、△S<0 B.該反應的平衡常數K= c4(HCl)c(SiCl4)×c2(H2)C.高溫下反應每生成1mol Si需消耗2×22.4L H2 D.用E表示鍵能,該反應△H=4E(Si-Cl)+2E(H-H)-4E(H-Cl) 組卷:679引用:17難度:0.5 -
5.一定條件下,向2L恒容密閉容器中加入6 mol M和2 mol N,發生反應3M(g)+N(g)?xP(g)+2Q(s),2min末該反應達到平衡,生成1.6 mol Q,并測得P的濃度為0.8mol?L-1。下列判斷錯誤的是( )
A.x=2 B.0~2 min內,M的平均反應速率為0.6mol?L-1?min-1 C.N的平衡轉化率為60% D.混合氣體的密度不再變化時,該反應達到了平衡狀態 組卷:24引用:2難度:0.6 -
6.在容積不變的密閉容器中存在如下反應:2A(g)+B(g)═3C(g)+D(s)△H<0,某研究小組研究了在其他條件不變時,改變某一條件對上述反應的影響,下列分析不正確的是( )
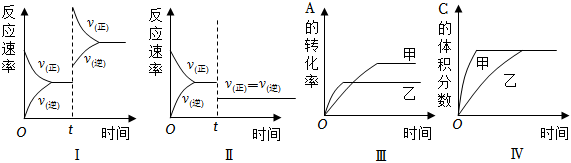
A.圖Ⅰ表示增加反應物濃度對該平衡的影響 B.圖Ⅱ表示減小壓強對該平衡的影響 C.圖Ⅲ表示溫度對該平衡的影響,溫度:乙>甲 D.圖Ⅳ表示催化劑對該平衡的影響,催化效率:甲>乙 組卷:165引用:25難度:0.9 -
7.向一密閉容器中充入1molH2(g)和1molI2(g),壓強為pPa,并在一定溫度下發生反應:H2(g)+I2(g)?2HI(g)△H<0,一段時間后反應達到平衡。下列說法不正確的是( )
A.保持容器容積不變,繼續向其中加入1molH2(g),反應正向進行 B.保持容器容積不變,繼續向其中加入1molN2(g)(N2不參加反應),化學反應速率不變 C.保持容器壓強不變,繼續向其中加入2molHI(g),重新達到新平衡時,H2的體積分數不變 D.提高起始反應溫度,正反應速率減慢,逆反應速率加快,平衡逆向移動 組卷:25引用:5難度:0.6 -
 8.兩個體積相同帶活塞的容器,分別盛裝一定量的NO2和Br2(g),都為紅棕色,兩容器中顏色深淺程度相同,迅速將兩容器同時壓縮到原來的一半(如圖),假設氣體不液化,則下列說法正確的是( )
8.兩個體積相同帶活塞的容器,分別盛裝一定量的NO2和Br2(g),都為紅棕色,兩容器中顏色深淺程度相同,迅速將兩容器同時壓縮到原來的一半(如圖),假設氣體不液化,則下列說法正確的是( )A.a→a′過程中,顏色突然加深,然后逐漸變淺,最終顏色比原來的深 B.a′、b′的顏色一樣深 C.a′、b′的壓強分別為a、b的壓強的2倍 D.a′中的c(NO2)一定比b′中的c(Br2)小 組卷:10引用:4難度:0.5 -
9.已知:
①2H2(g)+O2(g)═2H2O(1)ΔH=-571.6kJ?mol-1
②2CH3OH(1)+3O2(g)═2CO2(g)+4H2O(1)ΔH=-1452kJ?mol-1
③H+(aq)+OH-(aq)═H2O(1)ΔH=-57.3kJ?mol-1
則下列說法正確的是( )A.H2(g)燃燒熱ΔH=-571.6kJ?mol-1 B. H2SO4(aq)+12Ba(OH)2═12BaSO4(s)+H2O(l)△H=-57.3kJ?mol-112C.等質量的H2(g)和CH3OH(1)完全燃燒生成CO2和液態水,H2(g)放出的熱量多 D.2mol H2(g)在足量氧氣中完全燃燒生成氣態水放出的熱量大于571.6kJ 組卷:8引用:1難度:0.7
二、填空題
-
 28.三氯氧磷(POCl3)廣泛用于農藥、醫藥等化工生產中。工業制備三氯氧磷的過程中會產生副產品亞磷酸(H3PO3)。請回答下列問題:
28.三氯氧磷(POCl3)廣泛用于農藥、醫藥等化工生產中。工業制備三氯氧磷的過程中會產生副產品亞磷酸(H3PO3)。請回答下列問題:
(1)三氯氧磷可由三氯化磷、水、氯氣加熱反應生成,反應的化學方程式為。
(2)已知亞磷酸(H3PO3)為二元弱酸,則Na2HPO3溶液中,各離子濃度的大小關系為。
(3)常溫下,將NaOH溶液滴加到亞磷酸(H3PO3)溶液中,混合溶液的pH與離子濃度變化的關系如圖所示。表示lg的是曲線c(HPO2-3)c(H2PO-3)(填“Ⅰ”或“Ⅱ”),亞磷酸(H3PO3)的Ka1=,反應HPO32-+H2O?H2PO3-+OH-的平衡常數為。組卷:22引用:1難度:0.7 -
29.滴定實驗是化學學科中重要的定量實驗。請回答下列問題:
Ⅰ.酸堿中和滴定—已知某NaOH試樣中含有NaCl雜質,為測定試樣中NaOH的質量分數,進行如下實驗:
①稱量1.00g樣品溶于水,配成250mL溶液;
②準確量取25.00mL所配溶液于錐形瓶中;
③滴加兒滴酚酞溶液;
④用0.10mol?L-1的鹽酸標準液滴定三次,每次消耗鹽酸的體積記錄如表:
(1)用滴定序號 待測溶液體積/mL 所消耗鹽酸標準液的體積/mL 滴定前讀數 滴定后讀數 1 25.00 0.50 20.60 2 25.00 6.00 26.00 3 25.00 1.10 21.00 滴定管(填“酸式”或“堿式”)盛裝0.10mol?L-1的鹽酸標準液。
(2)試樣中NaOH的質量分數為。
(3)若出現下列情況,測定結果偏高的是(填序號)。
a.滴定前用蒸餾水沖洗錐形瓶
b.在振蕩錐形瓶時不慎將瓶內溶液濺出
c.若在滴定過程中不慎將數滴酸液滴在錐形瓶外
d.酸式滴定管滴至終點時,俯視讀數
e.酸式滴定管用蒸餾水洗后,未用標準液潤洗
Ⅱ.氧化還原滴定—化學探究小組用H2C2O4(草酸)溶液測定KMnO4溶液的濃度.請回答下列問題:
I、取20.00mL0.250mol/L H2C2O4標準溶液置于錐形瓶中,加入適量稀硫酸酸化,用KMnO4溶液進行滴定.滴定反應方程式為(未配平):KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O。
記錄數據如表:
(4)滴定時,KMnO4溶液應裝在滴定次數 標準溶液體積/mL 待測溶液體積/mL 滴定前刻度 滴定后刻度 1 20.00 1.50 23.70 2 20.00 1.02 21.03 3 20.00 2.00 21.99 滴定管中(選填:酸式、堿式)。
(5)滴定終點的判斷方法是:。
(6)根據上述數據計算,該KMnO4溶液的濃度為mol/L。
(7)下列操作中使得KMnO4溶液濃度偏低的是。
A.滴定管用水洗凈后直接注入KMnO4溶液
B.滴定前盛放標準H2C2O4溶液的錐形瓶用蒸餾水洗凈后沒有干燥
C.滴定管內在滴定前有氣泡,滴定后氣泡消失
D.讀取KMnO4溶液體積時,滴定前平視,滴定結束后俯視讀數組卷:70引用:1難度:0.6


