2018-2019學(xué)年廣東省深圳市新安中學(xué)高二(上)期中化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(共15小題,每小題3分,共45分。每個小題只有一個選項(xiàng)符合題意)
-
1.下列事實(shí)不用原電池原理解釋的是( )
A.輪船水線以下的船殼上裝一定數(shù)量的鋅塊 B.鐵被鈍化處理后不易腐蝕 C.純鋅與稀硫酸反應(yīng)時,滴入少量CuSO4溶液后反應(yīng)速率加快 D.燒過菜的鐵鍋加入清水放置,出現(xiàn)紅棕色的銹斑 組卷:26引用:5難度:0.9 -
2.下列措施或事實(shí)不能用勒沙特列原理解釋的是( )
A.工業(yè)上生產(chǎn)硫酸的過程中,使用過量的空氣以提高SO2的利用率 B.H2、I2、HI平衡混合氣加壓后顏色變深 C.實(shí)驗(yàn)室中常用排飽和食鹽水的方法收集氯氣 D.開啟啤酒瓶后,瓶中馬上泛起大量泡沫 組卷:11引用:3難度:0.9 -
3.下列說法正確的是( )
A.放熱反應(yīng)都是自發(fā)反應(yīng) B.若S(g)+O2(g)═SO2(g)△H1; S(s)+O2(g)═SO2(g)△H2,則△H1<△H2 C.凡是在加熱條件下進(jìn)行的反應(yīng)都是吸熱反應(yīng) D.同溫同壓下,H2(g)+Cl2(g)═2HCl(g)在光照和點(diǎn)燃條件下的△H不同 組卷:1引用:2難度:0.6 -
4.下列說法或表示方法不正確的是( )
A.蓋斯定律實(shí)質(zhì)上是能量守恒定律的體現(xiàn) B.在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ?mol-1,含0.5 mol H2SO4的濃硫酸與含1 mol NaOH的溶液混合,放出的熱量大于57.3 kJ C.由C(石墨)═C(金剛石)△H=+1.5 kJ?mol-1,可知,石墨比金剛石穩(wěn)定 D.H2(g)的燃燒熱是285.8kJ?mol-1,則2H2O (l)═2H2(g)+O2(g)△H=285.8kJ?mol-1 組卷:2引用:2難度:0.6 -
5.根據(jù)反應(yīng)Br+H2?HBr+H的能量對反應(yīng)歷程的示意圖甲進(jìn)行判斷,下列敘述中不正確的是( )
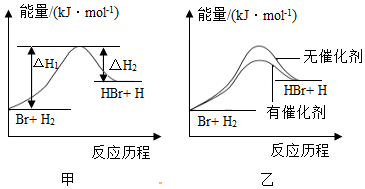
A.正反應(yīng)吸熱 B.加入催化劑,該化學(xué)反應(yīng)的反應(yīng)熱不變 C.加入催化劑后,該反應(yīng)的能量對反應(yīng)歷程的示意圖可用圖乙表示 D.加入催化劑可增大正反應(yīng)速率,降低逆反應(yīng)速率 組卷:181引用:25難度:0.9 -
6.下列條件一定能使反應(yīng)速率加快的是( )
①增加反應(yīng)物的物質(zhì)的量
②升高溫度
③縮小反應(yīng)容器的體積
④加入生成物
⑤加入MnO2.A.全部 B.①②⑤ C.② D.②③ 組卷:793引用:63難度:0.9
二.非選擇題(本大題共包括4小題,共55分)
-
18.(1)2017年中科院某研究團(tuán)隊(duì)通過設(shè)計(jì)一種新型Na—Fe3O4/HZSM-5多功能符合催化劑,成功實(shí)現(xiàn)了CO2直接加氫制取辛烷值汽油,該研究成果被評價為“CO2催化轉(zhuǎn)化領(lǐng)域的突破性進(jìn)展”。
已知:H2(g)+O2(g)=H2O(l)ΔH1 =-a kJ/mol12
C8H18 (l)+O2(g)=8CO2(g)+9H2O(l)ΔH2=-b kJ/mol252
試寫出25℃、101kPa條件下,CO2與H2反應(yīng)生成汽油(以C8H18表示)的熱化學(xué)方程式。
(2)利用CO2及H2為原料,在合適的催化劑(如Cu/ZnO催化劑)作用下,也可合成CH3OH,涉及的反應(yīng)有:
甲:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)ΔH=-53.7 kJ?mol-1 平衡常數(shù) K1
乙:CO2(g)+H2(g)?CO(g)+H2O(g)ΔH=+41.2 kJ?mol-1 平衡常數(shù)K2
①CO(g)+2H2(g)?CH3OH(g)的平衡常數(shù)K=(用含K1、K2的表達(dá)式表示),該反應(yīng)ΔH0(填“大于”或“小于”)。
②提高CO2轉(zhuǎn)化為CH3OH平衡轉(zhuǎn)化率的措施有(填寫兩項(xiàng))。
③催化劑和反應(yīng)體系的關(guān)系就像鎖和鑰匙的關(guān)系一樣,具有高度的選擇性。下列四組實(shí)驗(yàn),控制CO2和H2初始投料比均為1:2.2,經(jīng)過相同反應(yīng)時間(t1min)
由表格中的數(shù)據(jù)可知,相同溫度下不同的催化劑對CO2的轉(zhuǎn)化為CH3OH的選擇性有顯著影響,根據(jù)上表所給數(shù)據(jù)結(jié)合反應(yīng)原理,所得最優(yōu)選項(xiàng)為溫度(K) 催化劑 CO2轉(zhuǎn)化率(%) 甲醇選擇性(%) 綜合選項(xiàng) 543 Cu/ZnO納米棒材料 12.3 42.3 A 543 Cu/ZnO納米片材料 11.9 72.7 B 553 Cu/ZnO納米棒材料 15.3 39.1 C 553 Cu/ZnO納米片材料 12.0 70.6 D (填字母符號)。
(3)以CO、H2為原料合成甲醇的反應(yīng)為:CO(g)+2H2(g)?CH3OH(g)。在體積均為2L的三個恒容密閉容器Ⅰ、Ⅱ、Ⅲ中,分別都充入1mol CO和2mol H2,三個容器的反應(yīng)溫度分別為T1、T2、T3且恒定不變。圖1為三個容器中的反應(yīng)均進(jìn)行到5min時H2的體積分?jǐn)?shù)示意圖,其中有一個容器反應(yīng)一定達(dá)到平衡狀態(tài)。
①0~5 min時間內(nèi)容器Ⅱ中用CH3OH表示的化學(xué)反應(yīng)速率為。
②三個容器中一定達(dá)到平衡狀態(tài)的是容器(填寫容器代號)。組卷:24引用:5難度:0.5 -
 19.霧霾天氣頻繁出現(xiàn),嚴(yán)重影響人們的生活和健康。其中首要污染物為可吸入顆粒物PM2.5,其主要來源為燃煤、機(jī)動車尾氣等。請回答下列問題:
19.霧霾天氣頻繁出現(xiàn),嚴(yán)重影響人們的生活和健康。其中首要污染物為可吸入顆粒物PM2.5,其主要來源為燃煤、機(jī)動車尾氣等。請回答下列問題:
(1)已知汽車尾氣中汽缸中生成NO的反應(yīng)為:N2(g)+O2(g)?2NO(g)△H>0恒溫,恒容密閉容器中,下列說法中能說明該反應(yīng)達(dá)到化學(xué)平衡狀態(tài)的是
a.混合氣體的密度不再變化
b.混合氣體的平均相對分子質(zhì)量不再變化
c.N2、O2、NO的物質(zhì)的量之比為1:1:2
d.氧氣的百分含量不再變化
(2)已知汽車尾氣凈化原理為:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-746.5kJ?mol-1,則該反應(yīng)能自發(fā)進(jìn)行的條件是。(填“高溫”、“低溫”或“任意溫度”)。
(3)工業(yè)廢氣中的CO、CO2可用作合成甲醇的原料。
①用CO合成甲醇的反應(yīng)為CO(g)+2H2(g)?CH3OH(g)。在容積為1L的密閉容器中分別充入1mol CO和2mol H2,實(shí)驗(yàn)測得甲醇的物質(zhì)的量和溫度、時間的關(guān)系曲線如圖所示。則該反應(yīng)的△H0(填“<”、“>”或“=”),判斷的理由是。
②研究證實(shí),CO2也可在酸性水溶液中通過電解生成甲醇,則生成甲醇的反應(yīng)發(fā)生在極。
(4)活性炭可處理大氣污染物NO.在5L密閉容器中加入NO和活性炭(假設(shè)無雜質(zhì))。一定條件下生成氣體CO2和N2.某溫度下,測得各物質(zhì)平衡時物質(zhì)的量(n/mol)如表:
①計(jì)算上述反應(yīng)在該溫度時的平衡常數(shù)K=物質(zhì) 活性炭 NO CO2 N2 初始 3.000 0.10 0 0 平衡 2.960 0.020 0.040 0.040 ;
②上述反應(yīng)T1℃時達(dá)到化學(xué)平衡后再通入0.1molNO氣體,則達(dá)到新化學(xué)平衡時NO的轉(zhuǎn)化率為。組卷:3引用:2難度:0.6


