2018-2019學(xué)年北京八中高二(上)期中化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(每小題只有一個選項符合題意1~6每小題2分,7~20每小題2分,共54分)
-
1.測定中和熱的實驗中,使用下列物品不是為了減小實驗誤差的是( )
A.碎泡沫塑料 B.量筒 C.底部墊紙條 D.環(huán)形玻璃攪拌棒 組卷:7引用:1難度:0.7 -
2.在水中加入下列物質(zhì),可使水的電離平衡向右移動的是( )
A.NaCl B.KOH C.H2SO4 D.NH4Cl 組卷:2引用:2難度:0.8 -
3.下列事實可證明一水合氨是弱堿的是( )
A.銨鹽受熱易分解 B.0.1mol/L氨水可以使酚酞試液變紅 C.常溫時,0.1mol/L氨水溶液的pH約為11 D.能跟氯化亞鐵溶液反應(yīng)生成氫氧化亞鐵 組卷:65引用:4難度:0.7 -
4.下列溶液一定為酸性的是( )
A.含H+的溶液 B.加酚酞顯無色的溶液 C.pH<7的溶液 D.c(H+)> 的溶液Kw組卷:5引用:1難度:0.7 -
5.下列實驗操作和數(shù)據(jù)記錄都正確的是( )
A.用10 mL量筒量取NaCl溶液,體積為9.2 mL B.用25 mL堿式滴定管量取高錳酸鉀溶液,體積為16.60 mL C.用干燥的廣泛pH試紙測稀鹽酸的pH=3.2 D.用托盤天平稱量時,將NaOH固體放在左盤內(nèi)的紙上,稱得質(zhì)量為10.2 g 組卷:8引用:4難度:0.9 -
6.硫代硫酸鈉溶液與稀硫酸反應(yīng)的化學(xué)方程式為:Na2S2O3+H2SO4═Na2SO4+SO2+S↓+H2O,下列各組實驗中最先出現(xiàn)渾濁的是( )
實驗 反應(yīng)溫度/℃ Na2S2O3溶液 稀H2SO4 H2O V/mL c/(mol?L-1) V/mL c/(mol?L-1) V/mL A 25 5 0.1 10 0.1 5 B 25 5 0.2 5 0.2 10 C 35 5 0.15 5 0.15 5 D 35 5 0.2 5 0.2 20 A.A B.B C.C D.D 組卷:70引用:5難度:0.6 -
7.相同溫度下等物質(zhì)的量濃度的下列溶液中,c(
)值最小的是( )NH+4A.NH4Cl B.NH4HCO3 C.NH4HSO4 D.(NH4)2SO4 組卷:44引用:3難度:0.9 -
8.物質(zhì)的量濃度相同的三種鹽NaX、NaY和NaZ溶液pH值依次為8、9、10,則HX、HY、HZ酸性大小關(guān)系正確的是( )
A.HX>HY>HZ B.HX>HZ>HY C.HZ>HY>HX D.無法判斷 組卷:16引用:2難度:0.8
二、填空題(共46分)
-
24.自然界的礦物、巖石的成因和變化受到許多條件的影響.地殼內(nèi)每加深1km,壓強增大約25000~30000kPa.在地殼內(nèi)SiO2和HF存在以下平衡:SiO2(s)+4HF(g)═SiF4(g)+2H2O(g)+148.9kJ
根據(jù)題意完成下列填空:
(1)在地殼深處容易有氣體逸出,在地殼淺處容易有沉積.
(2)如果上述反應(yīng)的平衡常數(shù)K值變大,該反應(yīng)(選填編號).
a.一定向正反應(yīng)方向移動 b.在平衡移動時正反應(yīng)速率先增大后減小
c.一定向逆反應(yīng)方向移動 d.在平衡移動時逆反應(yīng)速率先減小后增大
(3)如果上述反應(yīng)在體積不變的密閉容器中發(fā)生,當反應(yīng)達到平衡時,(選填編號).
a.2v正(HF)=v逆(H2O) b.v(H2O)=2v(SiF4)
c.SiO2的質(zhì)量保持不變 d.反應(yīng)物不再轉(zhuǎn)化為生成物
(4)若反應(yīng)的容器容積為2.0L,反應(yīng)時間8.0min,容器內(nèi)氣體的密度增大了0.12g/L,在這段時間內(nèi)HF的平均反應(yīng)速率為.組卷:13引用:2難度:0.3 -
25.2SO2(g)+O2(g)?2SO3(g)是生產(chǎn)硫酸的主要反應(yīng)之一.下表是原料氣按V(SO2):V(O2):V(N2)=7:11:28投料,在1.01×105Pa時,不同溫度下SO2的平衡轉(zhuǎn)化率.
(1)該反應(yīng)是溫度/℃ 400 500 600 SO2轉(zhuǎn)化率/% 99.2 93.5 73.7 反應(yīng)(填“放熱”或“吸熱”).
(2)400℃,1.01×105Pa時,將含10mol SO2的原料氣通入一密閉容器中進行反應(yīng)平衡時SO2的物質(zhì)的量是mol.
(3)硫酸廠尾氣(主要成分為SO2、O2和N2)中低濃度SO2的吸收有很多方法.
①用氨水吸收上述尾氣,若尾氣中SO2與氨水恰好反應(yīng)得到弱堿性的(NH4)2SO3溶液,則有關(guān)該溶液的下列關(guān)系正確的是(填序號).
a.c(NH4+)+c(NH3?H2O)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
b.c(NH4+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
c.c(NH4+)>c(SO32-)>c(OH-)>c(H+)
②用MnO2與水的懸濁液吸收上述尾氣并生產(chǎn)MnSO4
i.得到MnSO4的化學(xué)方程式是
ii.該吸收過程生成MnSO4時,溶液的pH變化趨勢如圖甲,SO2的吸收率與溶液pH的關(guān)系如圖乙.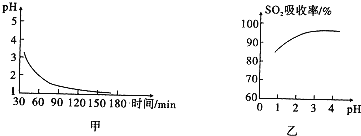
圖甲中pH變化是因為吸收中有部分SO2轉(zhuǎn)化為H2SO4生成H2SO4反應(yīng)的化學(xué)方程式是;由圖乙可知pH的降低SO2的吸收(填“有利于”或“不利于”),用化學(xué)平衡移動原理解釋其原因是.組卷:35引用:3難度:0.3


