2021年山東省淄博市高考化學一模試卷
發布:2024/4/20 14:35:0
一、選擇題:本題共10小題,每小題2分,共20分。每小題只有一個選項符合題意。
-
1.化學與生產、生活密切相關。下列說法錯誤的是( )
A.液氨可用作致冷劑 B.新冠疫苗一般應冷藏存放,以避免蛋白質變性 C.鋁制餐具適宜用來蒸煮堿性食物 D.防曬霜能減輕紫外線傷害的原因之一是其有效成分中含有π鍵 組卷:27引用:2難度:0.8 -
2.下列有關實驗安全和試劑回收處理的說法錯誤的是( )
A.蒸餾實驗中向沸騰的液體中補加沸石 B.用3%過氧化氫消毒液洗傷口 C.實驗室中將未用完的白磷放回原試劑瓶 D.用乙醇處理廢棄藥品中含有的少量金屬鈉 組卷:57引用:2難度:0.6 -
3.下列操作能夠達到實驗目的的是( )
目的 操作 A 除去CO2中混有的NO2 通過飽和Na2CO3溶液 B 檢驗K2CO3中是否含有鈉鹽 做焰色試驗,觀察火焰顏色 C 增大鋅粒與稀硫酸反應的速率 使用純度更高的鋅粒 D 證明非金屬性:Cl>S 將鹽酸與 NaHSO3混合產生的氣體通入品紅溶液 A.A B.B C.C D.D 組卷:18引用:2難度:0.5 -
4.W、X、Y和Z為原子序數依次增大的四種短周期主族元素,W與X可形成一種紅棕色有刺激性氣味的氣體;Y的周期序數是族序數的3倍;Z的最外層電子數與W的電子總數相同,下列敘述正確的是( )
A.第一電離能:X>W>Y B.簡單離子半徑:Y>X>W C.簡單氫化物的穩定性:X>W D.氧化物對應水化物的酸性:Z>W 組卷:13引用:1難度:0.5 -
5.NF3是微電子工業中一種優良的等離子蝕刻氣體,可通過電解熔融氟化氫銨(NH4HF2)制得。下列有關說法錯誤的是( )
A.NF3的空間構型為平面三角形 B.相關元素電負性由大到小的順序為F>N>H C.NF3和NH4HF2中N原子的雜化方式均為sp3 D.NH4HF2晶體中微粒間的作用有離子鍵、共價鍵、配位鍵、氫鍵 組卷:55引用:3難度:0.6 -
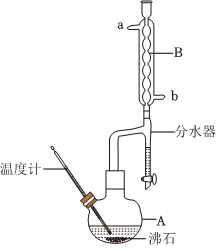 6.正丁醚常用作有機反應的溶劑,不溶于水,密度比水小,在實驗室中可利用反應2CH3CH2CH2CH2OHCH3(CH2)3O(CH2)3CH3+H2O制備,反應裝置如圖所示。下列說法正確的是( )濃硫酸135℃
6.正丁醚常用作有機反應的溶劑,不溶于水,密度比水小,在實驗室中可利用反應2CH3CH2CH2CH2OHCH3(CH2)3O(CH2)3CH3+H2O制備,反應裝置如圖所示。下列說法正確的是( )濃硫酸135℃A.裝置B中a為冷凝水進水口 B.為加快反應速率可將混合液升溫至170℃以上 C.若分水器中水層超過支管口下沿,應打開分水器旋鈕放水 D.本實驗制得的粗醚經堿液洗滌、干燥后即可得純醚 組卷:57引用:3難度:0.5
三、非選擇題:本題共5小題,共60分
-
19.透明鐵黃(FeOOH)是一種分散性良好的鐵系顏料。利用黃鈉鐵礬渣(主要成分Na2Fe6(SO4)4(OH)12,含少量BaSO4、CuSO4、CoSO4等)制備透明鐵黃工藝流程如圖。

已知:①25℃時相關物質的Ksp如下表。
②25°時H2S飽和溶液中,存在如下關系:c2(H+)?c(S2)=1×10-23.2。金屬硫化物 CuS CoS FeS Ksp 1×10-35.2 1×10-24.6 1×10-17.2
③當溶液中某離子濃度c≤1.0×10-5mol?L-1時,可認為該離子沉淀完全。
(1)“焙燒”前需要對反應混合物進行研磨粉碎,其目的是,“焙燒”時Na2Fe(SO4)4(OH)12首先發生分解反應,有Na2SO4、Fe2O3、SO3生成,反應的化學方程式為。
(2)“焙燒”過程中黃鈉鐵礬分解產生的Fe2O3最終轉化為FeO,則無煙煤所起的作用有。
(3)濾渣Ⅰ的主要成分是。(填化學式)
(4)“沉淀”過程中通入氨氣的目的是調節溶液pH,以控制S2-濃度,便于有效去除雜質金屬離子。若此時溶液中c(Fe2+)=1.0mol?L-1,雜質離子沉淀時溶液電H2S達到飽和,則操作中應控制的pH范圍為。
(5)“氧化”過程生成透明鐵黃的總反應離子方程式為。
(6)該工藝所得濾液經處理可獲得副產品硫酸銨和硫酸鈉,二者的溶解度隨溫度變化的曲線如圖所示。該工藝中濾液經加熱濃縮,首先析出硫酸銨,其原因是。 組卷:13引用:1難度:0.5
組卷:13引用:1難度:0.5 -
20.二氧化碳的高值化利用,不但可以實現二氧化碳的資源化利用,還可以緩解能源壓力。以二氧化碳、氫氣為原料合成乙烯涉及的主要反應如下。
Ⅰ.CO2(g)+H2(g)?CO(g)+H2O(g)△H1=+41.2kJ?mol-1
Ⅱ.2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H2=-128.1kJ?mol-1
(1)反應2CO(g)+4H2?C2H4(g)+2H2O(g)的△H=kJ?mol-1。
(2)543K時,二氧化碳的平衡轉化率、投料比[m=]與壓強的關系如圖甲所示,則m1、m2、m3由大到小的順序為n(CO2)n(H2)。
(3)在一定條件下,二氧化碳的平衡轉化率與產物的選擇性隨溫度的變化如圖乙所示。已知:某產物的選擇性是指生成該產物所消耗反應物的量占消耗的反應物總量的比例。
①當溫度低于773K時CO2的平衡轉化率隨溫度升高而減小的原因是。
②為同時提高合成乙烯的速率和乙烯的選擇性,可以采取的措施是。(只答一條)
(4)理論計算表明,體系壓強為3.1MPa,原料初始組成n(CO2):n(H2)=1:3,反應Ⅱ達到平衡時,CO2、H2、C2H4、H2O四種組分的體積分數x隨溫度T的變化如圖所示。圖丙中,表示乙烯和氫氣的曲線分別是和。根據圖中A點的坐標,計算該溫度時的平衡常數 Kp=(MPa)-3。(列出計算式。以分壓表示,分壓=總壓×物質的量分數)組卷:16引用:1難度:0.5


