2020-2021學年陜西省榆林十中高一(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本大題共16小題,每小題3分,計48分。每小題只有一個選項是符合題意的)
-
1.化學與生活、社會發展息息相關,下列說法不正確的是( )
A.裝運乙醇的包裝箱上應貼上易燃液體的危險品標志 B.為防止中秋月餅等富脂食品因被氧化而變質,常在包裝袋中放入生石灰 C.“忽聞海上有仙山,山在虛無縹緲間”的海市蜃樓是一種自然現象,與膠體知識有關 D.詩句“粉身碎骨渾不怕,要留清白在人間”中沒有涉及氧化還原反應 組卷:12引用:3難度:0.7 -
2.標準狀況下,相同體積的下列氣體,質量最大的是( )
A.H2 B.N2 C.CO D.CO2 組卷:63引用:5難度:0.5 -
3.下列物質的轉化,需要加入還原劑才能實現的是( )
A.SO3→H2SO4 B.Cu→Cu(NO3)2 C.Fe2O3→Fe D.CO→CO2 組卷:177引用:4難度:0.6 -
4.在3mL碘水中,加入1mL四氯化碳,振蕩、靜置后,觀察到試管里的分層現象是(注:如圖試管中深色區為紫紅色溶液)( )
A. 
B. 
C. 
D.  組卷:9引用:8難度:0.7
組卷:9引用:8難度:0.7 -
5.下列有關膠體的說法正確的是( )
A.江河入海口三角洲的形成與膠體的性質有關 B.實驗室制備氫氧化鐵膠體時,采用的方法是向沸水中滴加硫酸鐵溶液 C.直徑介于1nm~10mm之間的微粒稱為膠體 D.膠體區別于其它分散系的本質特征是能產生丁達爾效應 組卷:29引用:2難度:0.8 -
6.下列溶液中,Cl-的物質的量濃度與50mL 1mol?L-1 AlCl3溶液中Cl-物質的量濃度相等的是( )
A.150mL 2 mol?L-1 KCl溶液 B.75mL 1.5 mol?L-1 MgCl2溶液 C.100mL 1 mol?L-1 NaCl溶液 D.25mL 2 mol?L-1 AlCl3溶液 組卷:127引用:13難度:0.7 -
7.下列邏輯關系圖中正確的是( )
A. 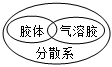
B. 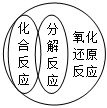
C. 
D. 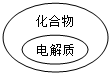 組卷:69引用:3難度:0.8
組卷:69引用:3難度:0.8
二、非選擇題(本大題共5小題,計52分)
-
20.某化學興趣小組同學探究金屬鈉與飽和燒堿溶液的反應,方法如下:
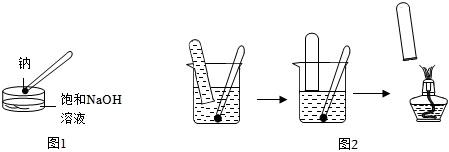
(1)按圖1所示的方法,在室溫時,向盛有飽和NaOH溶液的水槽中,加入一小塊金屬鈉,下列有關描述正確的是。(填字母)
a.鈉浮在液面上,并四處游動,最后消失
b.鈉熔化成一個閃亮的小球
c.恢復到室溫時,NaOH溶液的濃度增大
d.恢復到室溫時,溶液中Na+數目減少
(2)寫出該反應的化學方程式。
(3)按圖2所示方法來收集金屬鈉與水反應產生的氣體,需將鈉包好再放入水中。在相同條件下,取相同質量的鈉,按下列兩種情況進行操作,收集產生的氣體較多的是操作(填序號),并用離子方程式解釋其原因。
①用鋁箔包住鈉
②用銅箔包住鈉
(4)配制飽和NaOH溶液時有部分NaOH固體剩余,現用該固體配制1.0mol/L的NaOH溶液460mL。
①配制該溶液需要稱取NaOH固體g。
②完成本實驗所需儀器除托盤天平、玻璃棒、膠頭滴管、燒杯、量筒外,還需要的儀器是。
③下列操作會導致所配溶液濃度偏高的是。(填字母)
A.稱量時砝碼已經生銹
B.溶解、轉移溶液之后沒有對燒杯和玻璃棒進行洗滌操作
C.定容時俯視
D.定容時,液面超過容量瓶頸上的刻度線,用膠頭滴管將過量的液體吸出
E.容量瓶不干燥,含有少量蒸餾水組卷:36引用:2難度:0.7 -
21.高錳酸鉀是一種典型的強氧化劑。
Ⅰ.用KMnO4酸性溶液處理Cu2S和CuS的混合物時,發生如下反應:
①MnO4-+Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)
②MnO4-+CuS+H+→Cu2++SO2↑+Mn2++H2O(未配平)
(1)反應①中被氧化的元素是,氧化劑與還原劑的物質的量之比為。
(2)當反應①中轉移0.8mol電子,生成SO2的體積為L。(標準狀況下)
(3)配平并用單線橋法標出反應②中電子轉移的方向和數目。
Ⅱ.在稀硫酸中,MnO4-和H2O2能發生氧化還原反應:
氧化反應:H2O2-2e-═2H++O2↑
還原反應:MnO4-+5e-+8H+═Mn2++4H2O
(4)寫出該氧化還原反應的化學方程式。
(5)反應中若有0.5mol H2O2參加此反應,轉移電子的個數為。
(6)由上述反應得出物質氧化性強弱的結論是KMnO4(填“>”或“<”)H2O2。
(7)實驗中發現,當加入的少量KMnO4完全反應后,H2O2仍能發生反應放出氣體,其原因可能是。組卷:27引用:2難度:0.6


