2021-2022學年上海中學高一(下)期末化學試卷
發布:2024/4/20 14:35:0
一、單項選擇題
-
1.在下列過程中,需要增大化學反應速率的是( )
A.鋼鐵腐蝕 B.食物腐敗 C.牛奶變質 D.工業合成氨 組卷:28引用:2難度:0.7 -
2.下列條件的變化,是因為降低反應所需的能量而增加單位體積內的反應物活化分子百分數致使反應速率加快的是( )
A.增大濃度 B.增大壓強 C.升高溫度 D.使用催化劑 組卷:77引用:9難度:0.5 -
3.下列有關金屬腐蝕與防護的說法不正確的是( )
A.純銀器表面在空氣中因化學腐蝕漸漸變暗 B.當鍍錫鐵制品的鍍層破損時,鍍層仍能對鐵制品起保護作用 C.在海輪外殼連接鋅塊保護外殼不受腐蝕是采用了犧牲陽極的陰極保護法 D.可將地下輸油鋼管與外加直流電源的負極相連以保護它不受腐蝕 組卷:86引用:3難度:0.7 -
4.下列敘述錯誤的是( )
A.碳酸氫鈉加熱可以分解,因為升高溫度利于熵增的方向自發進行 B.在溫度、壓強一定的條件下,自發反應總是向ΔH-TΔS<0的方向進行 C.水結冰的過程不能自發進行的原因是熵減的過程,改變條件也不可能自發進行 D.混亂度減小的吸熱反應一定不能自發進行 組卷:84引用:1難度:0.8 -
 5.關于如圖所示裝置的敘述,正確的是( )
5.關于如圖所示裝置的敘述,正確的是( )A.銅是陽極,銅片上有氣泡產生 B.銅片質量逐漸減少 C.電流方向從鋅片經導線流向銅片 D.銅離子在銅片表面被還原 組卷:33引用:12難度:0.7 -
6.關于工業合成氨的敘述中錯誤的是( )
A.在動力、設備、材料允許的條件下盡可能在高壓下進行 B.溫度越高越有利于工業合成氨 C.在工業合成氨中N2、H2的循環利用可提高其利用率,降低成本 D.及時從反應體系中分離出氨氣有利于平衡向正反應方向移動 組卷:102引用:9難度:0.7
二、綜合題
-
18.某化學課外小組的同學準備通過實驗探究,加深對化學反應速率和化學反應限度的認識。
實驗一:探究溫度和濃度對反應速率的影響
實驗原理及方案:在酸性溶液中,碘酸鉀(KIO3)和亞硫酸鈉可發生反應生成碘,生成的碘可用淀粉溶液檢驗,根據出現藍色所需的時間來衡量該反應的速率。
(1)上述表格中:V1=實驗序號 0.01mol/LKIO3酸性溶液(含淀粉)的體積/mL 0.01mol/LNa2SO3溶液的體積/mL 水的體積/mL 實驗溫度/℃ 出現藍色的時間/s ① 5 5 V1 0 ② 5 5 40 25 ③ 5 V2 35 25 mL,V2=mL。
實驗二:探究KI和FeCl3混合時生成KCl、I2和FeCl2的反應存在一定的限度。
實驗步驟:
i.向5mL,0.01mol/LKI溶液中滴加5~6滴0.01mol/LFeCl3溶液,充分反應后,將所得溶液分成甲、乙兩等份;
ii.向甲中滴加CCl4,充分振蕩;
iii.向乙中滴加KSCN。
請回答下列問題:
(2)KI和FeCl3在溶液中反應的離子方程式為:2I-+2Fe3+?I2(溶液)+2Fe2+,寫出該反應的平衡常數K的表達式。
(3)步驟和iii中的實驗現象說明KI和FeCl3混合時生成KCl、I2和FeCl2的反應存在一定的限度,則步驟ii中的實驗現象是,且步驟iii中的實驗現象是。
實驗三:對鋁片與相同H+濃度的鹽酸和硫酸在同溫同壓下反應時,鋁和鹽酸反應速率更快的原因探究。填寫下列空白:
①該同學認為:由于預先控制了反應的其他條件,那么,兩次實驗時反應的速率不一樣的原因,只有以下五種可能:
原因Ⅰ:Cl-對反應具有促進作用,而SO42-對反應沒有影響;
原因Ⅱ:Cl-對反應沒有影響,而SO42-對反應具有阻礙作用;
(4)原因Ⅲ:;
原因Ⅳ:Cl-、SO42-均對反應具有促進作用,但Cl-影響更大;
(5)原因Ⅴ:。
②該同學設計并進行了兩組實驗,即得出了正確結論。他取了兩片等質量、外形和組成相同、表面經過砂紙充分打磨的鋁片,分別放入到盛有同體積、c(H+)相同的稀硫酸和鹽酸的試管(兩試管的規格相同)中:
a.在盛有硫酸的試管中加入少量NaCl或KCl固體,觀察反應速率是否變化;
b.在盛有鹽酸的試管中加入少量Na2SO4或K2SO4固體,觀察反應速率是否變化。
(6)若原因I是正確的,則應觀察到的現象是:實驗a中,實驗b中。組卷:73引用:1難度:0.5 -
19.合成氨技術的創立開辟了人工固氮的重要途徑,其研究來自正確的理論指導,合成氨反應的平衡常數K值和溫度的關系如表:
①由上表數據可知該反應為溫度(℃) 360 440 520 K值 0.036 0.010 0.0038 反應(填“放熱”或“吸熱”或“無法確定”)。
②下列措施能用勒夏特列原理解釋是(填序號)。
a.增大壓強有利于合成氨
b.使用合適的催化劑有利于快速生成氨
c.生產中需要升高溫度至500℃左右
d.需要使用過量的N2,提高H2轉化率
(1)0.2mol氨氣溶于水后再與含有0.2mol硫酸的溶液恰好完全反應放熱QkJ,寫出該反應的熱化學方程式(溶液用aq表示):。
(2)已知N2(g)和H2(g)反應生成1molNH3(g)過程中能量變化如圖所示(E1=1127kJ,E2=1173kJ)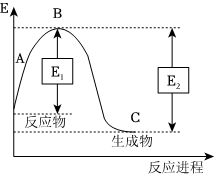
根據以上鍵能數據計算N-H鍵的鍵能為化學鍵 H-H N≡N 鍵能(kJ/mol) 436 946 kJ/mol。
(3)原料氣H2可通過反應CH4(g)+H2O(g)?CO(g)+3H2(g)獲取,已知該反應中,當初始混合氣中的甲烷與水蒸氣的物質的量之比恒定時,溫度、壓強對平衡混合氣CH4含量的影響如圖所示: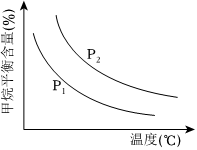
①圖中,兩條曲線表示壓強的關系是:P1P2(填“>”或“=”或“<”)。
②其它條件一定,升高溫度,CH4的轉化率會(填“增大”或“減小”或“不變”)。
(4)原料氣H2還可通過反應CO(g)+H2O(g)?CO2(g)+H2(g)獲取。
①T℃時,向容積固定為5L的容器中充入1mol水蒸氣和1molCO,反應達平衡后,測得CO的濃度為0.08mol/L,該溫度下反應的平衡常數K值為。
②保持溫度仍為T℃,容積體積為5L,改變水蒸氣和CO的初始物質的量之比,充入容器進行反應,下列描述能夠說明體系處于平衡狀態的是(填序號)。
a.容器內壓強不隨時間改變
b.混合氣體的密度不隨時間改變
c.單位時間內生成amolCO2的同時消耗amolH2
d.混合氣中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6組卷:38引用:1難度:0.5


